Mục tiêu của đề tài là ứng dụng vi khuẩn kết tụ kết hợp PAC+Polymer và cánh đồng lọc xử lý nước rỉ rác sau xử lý vi khuẩn khử đạm, lân. Đề tài được thực hiện qua 2 thí nghiệm là keo tụ nước rỉ rác sau xử lý vi khuẩn khử đạm, lân và lọc nước sau keo tụ xử lý. Nước rỉ rác sau xử lý vi khuẩn khử đạm, lân được thu lại để tiến hành keo tụ. Quá trình keo tụ được thực hiện bởi vi khuẩn Enterobacter aerogenes dòng P11 kết hợpPAC+Polymer. Kết quả cho thấy quá trình keo tụ độ pH ít thay đổi và xử lý rất tốt hàm lượng PO43 đạt mức dưới 1mgL và một phần hàm lượng COD, TSS, TKN, TP có trong nước. Nghiệm thức sử dụng vi khuẩn Enterobacter aerogenes dòng P11 kết hợp PAC cho hiệu quả tốt, thân thiện môi trường và ít tốn kém. Nước sau khi keo tụ được đưa vào lọcqua các vật liệu khác nhau.
GIỚI THIỆU
Đặt vấn đề
Nước rò rỉ từ bãi chôn lấp, hay còn gọi là nước rỉ rác, là nước bẩn thấm qua lớp rác, mang theo chất ô nhiễm có thể làm nhiễm bẩn nguồn nước ngầm và nước mặt nếu không được xử lý triệt để Với thành phần phức tạp và khả năng gây ô nhiễm cao, nước rỉ rác cần một dây chuyền công nghệ xử lý kết hợp nhiều giai đoạn, bao gồm xử lý sơ bộ, bậc hai và bậc ba để đạt tiêu chuẩn thải Thành phần và lưu lượng nước rò rỉ thay đổi theo mùa và thời gian chôn lấp, do đó, dây chuyền xử lý cũng cần được điều chỉnh Việc tìm kiếm giải pháp xử lý nước rò rỉ cho các bãi chôn lấp đáp ứng điều kiện kinh tế, kỹ thuật và khí hậu Việt Nam đang là một thách thức quan trọng hiện nay.
Nhiều nghiên cứu đã tìm kiếm các biện pháp hiệu quả để loại bỏ chất ô nhiễm trong nước thải, trong đó quá trình kết tụ (flocculation) đóng vai trò quan trọng trong việc trầm lắng các chất độc hại, kết hợp với lọc bằng cánh đồng thực vật Các hóa chất được sử dụng để kết tụ nhanh chóng và thường được áp dụng trong xử lý nước thải, chia thành ba nhóm chính: kết tụ vô cơ (như phèn chua), chất kết tụ hữu cơ tổng hợp (như polyacrylamide) và chất kết tụ tự nhiên (như chitosan) Mặc dù hóa chất này có giá thành rẻ, nhưng chúng có thể gây hại cho sức khỏe con người và môi trường, ví dụ như nhôm có liên quan đến bệnh Alzheimer và polyacrylamide là độc tố và chất gây ung thư Trong khi đó, chất kết tụ sinh học (bioflocculants) được sản xuất từ vi sinh vật là lựa chọn an toàn, không độc hại và có khả năng tác động nhanh chóng.
Đề tài “Ứng dụng vi khuẩn kết tụ kết hợp hóa chất PAC+Polymer và cánh đồng lọc xử lý nước rỉ rác sau xử lý vi khuẩn đạm, lân” được thực hiện nhằm cải thiện hiệu quả xử lý nước rỉ rác Việc kết hợp vi khuẩn và hóa chất PAC+Polymer sẽ tối ưu hóa quá trình lọc và xử lý, mang lại kết quả tốt hơn cho môi trường.
Mục tiêu đề tài
Ứng dụng vi khuẩn kết tụ kết hợp phương pháp hóa học và cánh đồng lọc xử lý nước rỉ rác sau xử lý sinh học
Nước sau khi qua quá trình lọc đạt quy chuẩn chất lượng nước QCVN 25: 2009/BTNMT của Bộ Tài nguyên và Môi trường.
Nội dung nghiên cứu
Sử dụng vi khuẩn kết tụ sinh học kết hợp với hóa chất PAC và Polymer, cùng với cánh đồng lọc, là phương pháp hiệu quả để xử lý nước rỉ rác sau khi đã tiến hành khử đạm và lân bằng vi khuẩn.
LƯỢC KHẢO TÀI LIỆU
Sự hình thành nước rỉ rác
Nước rò rỉ từ bãi rác, hay còn gọi là nước rỉ rác, là loại nước bẩn thấm qua lớp rác và mang theo các chất ô nhiễm xuống tầng đất dưới bãi chôn lấp Trong quá trình hoạt động của bãi chôn lấp, nước rỉ rác chủ yếu hình thành từ nước mưa và nước “ép” ra từ các lỗ rỗng của chất thải do các thiết bị đầm nén.
Quá trình hình thành nước rò rỉ bắt đầu khi bãi rác đạt đến khả năng giữ nước (Field Capacity - FC) hoặc khi bị bão hòa nước FC của chất thải rắn là tổng lượng nước mà bãi rác có thể giữ lại dưới tác động của trọng lực, đóng vai trò quan trọng trong việc xác định sự hình thành nước rò rỉ FC thay đổi tùy thuộc vào trạng thái nén của rác và quá trình phân hủy chất thải Cả rác và lớp phủ đều có khả năng giữ nước trước sức hút của trọng lực, và FC có thể được tính toán bằng một công thức cụ thể.
- FC : khả năng giữ nước (tỷ lệ giữ nước và trọng lượng khô của chất thải rắn)
- W : khối lượng vượt tải (overburden weight) được tính tại chính giữa chiều cao ô chôn lấp, pound
Nước rò rỉ từ bãi chôn lấp chủ yếu xuất phát từ nước mưa, độ ẩm của rác, vật liệu phủ và bùn nếu có Sự mất nước trong bãi rác bao gồm nước tiêu thụ trong các phản ứng khí, hơi nước bão hòa và nước thoát ra từ đáy bãi chôn lấp Các yếu tố như khí tượng, thủy văn, địa hình và địa chất, đặc biệt là khí hậu và lượng mưa, ảnh hưởng lớn đến lượng nước rò rỉ Tốc độ phát sinh nước rò rỉ thay đổi theo từng giai đoạn hoạt động của bãi rác, với phần lớn nước mưa được hấp thụ và lưu trữ trong những năm đầu Lưu lượng nước rò rỉ sẽ tăng dần theo thời gian hoạt động của bãi rác.
Sau khi đóng cửa bãi chôn lấp, độ ẩm trong đất giảm dần nhờ vào lớp phủ cuối cùng và lớp thực vật được trồng lên bề mặt, giúp giữ nước và hạn chế độ ẩm thấm vào.
Quá trình phân hủy chất thải rắn tại bãi chôn lấp bắt đầu với giai đoạn thích nghi ban đầu, diễn ra ngay sau khi chất thải được chôn lấp Trong giai đoạn này, các quá trình phân hủy hiếu khí sẽ hoạt động nhờ vào lượng không khí còn lại trong bãi rác Thời gian của giai đoạn này có thể kéo dài từ vài ngày đến vài tháng, tùy thuộc vào tốc độ phân hủy và sự hiện diện của các vi sinh vật hiếu khí và kị khí.
Giai đoạn II - giai đoạn chuyển tiếp, diễn ra khi oxy trong môi trường bị cạn kiệt, dẫn đến sự chuyển hóa sang trạng thái kị khí Trong giai đoạn này, nitrat và sulphat trở thành chất nhận điện tử cho các phản ứng sinh học, tạo ra khí nitơ và hydro sulfit Khi mức oxy hóa giảm, cộng đồng vi khuẩn bắt đầu phân hủy chất hữu cơ trong rác thải thành CH4 và CO2 thông qua quá trình ba bước: thủy phân, lên men axit và lên men metan, chuyển hóa chất hữu cơ thành axit hữu cơ và các sản phẩm trung gian khác (giai đoạn III) Đồng thời, pH của nước rò rỉ cũng giảm xuống do sự hình thành axit hữu cơ và sự gia tăng nồng độ CO2 trong bãi rác.
Giai đoạn III - giai đoạn lên men axit, bắt đầu khi nồng độ axit hữu cơ tăng và lượng H2 giảm Quá trình này bắt đầu với sự thủy phân các hợp chất cao phân tử như lipit, polysacarit và protein thành các chất đơn giản hơn cho vi sinh vật Tiếp theo, các chất này được chuyển hóa thành các hợp chất trung gian phân tử lượng thấp như axit acetic và axit fulvic, cùng với một số axit hữu cơ khác Trong giai đoạn này, khí cacbonic được sản xuất nhiều nhất, trong khi một lượng nhỏ H2S cũng được hình thành.
Giai đoạn IV, hay giai đoạn lên men metan, là giai đoạn mà nhóm vi sinh vật thứ hai chuyển hóa axit acetic và khí hydro thành metan (CH4) và carbon dioxide (CO2) Trong giai đoạn này, vi khuẩn metan, một nhóm vi sinh vật kị khí nghiêm ngặt, chiếm ưu thế Mặc dù sự hình thành axit hữu cơ giảm, nhưng quá trình tạo metan và các axit hữu cơ vẫn diễn ra đồng thời Kết quả là, nồng độ BOD5, COD, kim loại nặng và độ dẫn điện của nước rò rỉ đều giảm trong giai đoạn này.
Giai đoạn V, hay giai đoạn ổn định, diễn ra khi các vật liệu hữu cơ dễ phân hủy sinh học đã được chuyển hóa thành CH4 và CO2 trong giai đoạn IV Trong giai đoạn này, nước tiếp tục di chuyển trong bãi chôn lấp, giúp các chất hữu cơ chưa phân hủy tiếp tục được chuyển hóa Tốc độ phát sinh khí giảm đáng kể, với khí sinh ra chủ yếu là CH4 và CO2 Lượng nước rò rỉ chứa axit humic và axit fulvic làm cho quá trình phân hủy sinh học trở nên khó khăn hơn Tuy nhiên, theo thời gian, hàm lượng axit humic và fulvic trong bãi chôn lấp sẽ giảm xuống.
Hình 1: Quá trình phân hủy sinh học trong bãi chôn lấp
Nước rò rỉ từ các bãi rác mới chôn lấp chất thải rắn có pH thấp, BOD5 và VFA cao, cùng với hàm lượng kim loại nặng cao, đặc trưng cho các giai đoạn I, II, III và một phần giai đoạn IV của bãi chôn lấp Sau một thời gian dài chôn lấp, các chất hữu cơ chuyển sang giai đoạn metan, dẫn đến sự giảm đáng kể của các thành phần ô nhiễm trong nước rò rỉ Sự gia tăng pH cũng góp phần làm giảm nồng độ các chất vô cơ, đặc biệt là kim loại nặng trong nước rò rỉ.
Phương pháp xử lý nước rỉ rác củ
Nước rò rỉ tại các bãi chôn lấp lâu năm thường chứa nhiều hợp chất hữu cơ phức tạp và khó phân hủy sinh học, với hàm lượng nitrogen (N) cao, trong đó 90% tồn tại dưới dạng pH và COD.
NH3, khí thải ra môi trường sẽ gây đọc cho thủy sinh và hiện tượng phú dưỡng hóa
Thành phần và tính chất nước rác của bải chôn lấp Đông Thạnh được cho trong bảng
Bảng 1: Thành phần và tính chất nước rác bãi chôn lấp Đông Thạnh
STT Thành Phần Đơn vị Nước rác Đông Thạnh
Kết quả khảo sát chất lượng nước bãi rác Đông Thạnh cho thấy tỉ lệ BOD/COD rất thấp (0,15-0,25), thể hiện khả năng phân hủy sinh học kém và độ cứng cao, gây khó khăn cho xử lý sinh học Do đó, việc áp dụng các biện pháp hóa lý và hóa học là cần thiết Nghiên cứu chỉ ra rằng hiệu quả xử lý COD bằng chất oxy hóa mạnh đạt cao trong thời gian ngắn Tuy nhiên, nếu chỉ sử dụng phương pháp oxy hóa, nước sau xử lý không đạt yêu cầu và chi phí hóa chất cao Vì vậy, trước khi áp dụng biện pháp oxy hóa, phản ứng oxy hóa với H2O2 và xúc tác FeSO4 có thể giảm COD đến tiêu chuẩn loại B, với liều lượng H2O2 từ 2-3 l/m³ và FeSO4 từ 3-5 kg/m³.
Quy trình công nghệ hệ thống xử lý nước rác cũ như sau:
Hình 2: Sơ đồ công nghệ hệ thông xử lý nước rỉ rác cũ
Nước rác được thu gom từ các hố thu và qua song chắn rác để loại bỏ tạp chất, sau đó vào bể điều hòa để điều chỉnh lưu lượng và chất lượng nước Tiếp theo, nước thải được đưa vào bể sục khí nhằm giảm COD dễ phân hủy và khử Nitơ Sau đó, nước thải trải qua bể keo tụ với phèn bùn ở pH 5 và hàm lượng 2000-2500 mg/l Tiếp theo, COD trong nước thải được oxy hóa bằng H2O2 với xúc tác mangan và sắt (II), với liều lượng H2O2 và FeSO4 lần lượt là 2-3 l/m³ và 3-5 kg/m³ Cuối cùng, nước sau xử lý đạt tiêu chuẩn loại B, và bùn từ bể keo tụ và bể oxy hóa sẽ được thu gom, xử lý và chôn cất tại bãi rác.
Sự kết tụ trong xử lý nước thải
Kết tụ là bước quan trọng trong quá trình xử lý nước thải, giúp loại bỏ tạp chất bẩn hiệu quả Quá trình này không chỉ giảm thiểu thời gian xử lý mà còn tạo điều kiện thuận lợi cho các giai đoạn xử lý tiếp theo.
Sự kết tụ được phân thành ba nhóm chính: kết tụ vô cơ như phèn chua (aluminium sulphat và chloride aluminium), kết tụ hữu cơ tổng hợp từ polyacrylamide và polyethylene imine, và kết tụ tự nhiên như chitosan, sodium alginate cùng với kết tụ vi sinh vật (microbial flocculants) Mặc dù các hóa chất này có giá thành rẻ, nhưng chúng có thể ảnh hưởng tiêu cực đến sức khỏe con người và môi trường, ví dụ như nhôm, được cho là nguyên nhân gây ra bệnh Alzheimer.
Các dẫn xuất từ polyacrylamide không chỉ độc hại cho hệ thần kinh mà còn có khả năng gây ung thư và khó phân hủy trong môi trường (Yokoi et al, 1994) Ngược lại, kết tụ sinh học do vi sinh vật thực hiện đang được công nhận về tính khoa học và thu hút sự quan tâm trong ngành công nghệ sinh học môi trường, nhờ vào khả năng phân giải sinh học và tính không độc hại của chúng (Lu et al 2005).
Keo tụ hóa học trong xử lý nước thải
Các phân tử hoặc nguyên tử liên kết với nhau để hình thành các hạt bông keo Trong quá trình khuấy trộn, các hạt bông keo này kết dính lại với nhau, tạo thành các hạt bông keo lớn hơn và cuối cùng lắng xuống.
2.4.2 Chất keo tụ và trợ keo tụ
Chất keo tụ đóng vai trò quan trọng trong việc trung hòa các cực mang điện tích, giúp chúng kết hợp lại thành các hạt bông keo Các loại chất keo tụ thường được sử dụng bao gồm phèn nhôm, phèn sắt và poly aluminium chloride (PAC).
Chất trợ keo tụ giúp tăng mật độ và tốc độ lắng của các hạt bông keo, đồng thời cải thiện sự bền vững của chúng trong quá trình hòa trộn và lắng cặn Polymer kết tách tổng hợp, như Polyacrylamid và Natrisilicat, thường được sử dụng trong ứng dụng này.
2.4.3 Sơ lược Poly aluminium chloride (PAC)
Poli tiên tiến (PAC) là một chất keo tụ thế hệ mới, tồn tại dưới dạng polymer vô cơ, đã được sản xuất với quy mô lớn PAC được sử dụng rộng rãi để thay thế phèn nhôm sunfat trong xử lý nước sinh hoạt và đặc biệt là trong xử lý nước thải.
Tính chất: PAC có công thức tổng quát là [Al2(OH)nCl6.nxH2O]m (trong đó m
PAC thương mại là bột thô có màu vàng nhạt hoặc vàng đậm, dễ tan trong nước và có khả năng tỏa nhiệt Dung dịch PAC tạo ra trong suốt và có tác dụng mạnh mẽ trong việc hút thấm.
PAC có nhiều ưu điểm so với phèn nhôm sunfat và các loại phèn vô cơ khác:
Hiệu quả keo tụ và lắng của sản phẩm đạt từ 4-5 lần, với khả năng tan trong nước tốt và nhanh chóng Điều này giúp giảm thiểu biến động độ pH của nước, không cần sử dụng NaOH để xử lý, từ đó làm giảm tình trạng ăn mòn thiết bị.
- Không làm đục nước khi dùng thừa hoặc thiếu
- Không cần (hoặc dùng rất ít) phụ gia trợ keo tụ và trợ lắng
- [Al] dư trong nước < so với khi dùng phèn nhôm sunfat
- Khả năng loại bỏ các chất hữu cơ tan và không tan cùng các kim loại nặng tốt hơn
- Không làm phát sinh hàm lượng SO4 2- trong nước thải sau xử lí là loại có độc tính đối với vi sinh vật
Polymer một chất trợ keo tụ, có cấu trúc phân tử lớn và mang điện tích sử dụng nhiều trong xử lý keo tụ
+Chúng được chia làm 3 loại: C-Cationic, A-Anionic, N-Nonionic
C-Cationic: tan trong nước phân tử polymer tích điện dương
A-Anionic: tan trong nước phân tử polimer tích điện âm
N-Nonionic: tan trong nước phân tử polimer không mang điện.
Kết tụ sinh học trong xử lý nước thải
2.5.1 Khái niệm kết tụ sinh học
Kết tụ sinh học là quá trình mà vi sinh vật tổng hợp các chất đa phân tử có khả năng kết tụ, giúp thu gom và lắng đọng các vật chất lơ lửng trong dung dịch Vi khuẩn sử dụng các chất dinh dưỡng từ môi trường để tạo ra các chất đa phân tử dưới sự tác động của các enzym đặc biệt Những chất này có thể được bài tiết ra ngoài hoặc tồn tại trên bề mặt tế bào vi khuẩn, biến đổi các chất trong môi trường thành những đa phân tử phức tạp phục vụ cho quá trình kết tụ Các chất kết tụ sinh học có thể là protein, polysaccharide hoặc glycoprotein.
2.5.2 Cơ chế của quá trình kết tụ sinh học
Khối lượng phân tử và các nhóm chức trong chuỗi phân tử của chất kết tụ sinh học do vi sinh vật sản sinh đóng vai trò quan trọng trong hiệu quả kết tụ Chất kết tụ sinh học dạng protein có nhóm amino và carboxyl là các nhóm chức năng, nhưng thường có trọng lượng phân tử thấp Ngược lại, chất kết tụ sinh học dạng polysaccharide thường có trọng lượng phân tử cao và nhiều nhóm chức năng hơn Thành phần và cấu trúc của chất kết tụ sinh học rất phức tạp, với sự đa dạng từ các nhóm vi sinh vật khác nhau, dẫn đến các đặc tính khác nhau của chất kết tụ sinh học.
2.5.3 Kiểm tra khả năng kết tụ của vi khuẩn sản sinh chất kết tụ sinh học với dung dịch Kaolin
Kaolin là một khoáng sét có công thức là Al2Si2O5(OH)4 và công thức cấu tạo (Hình
Để đánh giá khả năng kết tụ của chất kết tụ sinh học từ vi khuẩn, các chất được nghiền mịn và hòa tan trong nước tạo thành dung dịch lơ lửng Qua quá trình này, đa phân tử kết tụ sinh học sẽ hấp thụ các phân tử Kaolin trong dung dịch, khiến chúng lắng xuống đáy và làm trong dung dịch Độ trong của dung dịch được xác định bằng cách đo lường.
OD tại bước sóng 550nm là chỉ số quan trọng để đánh giá khả năng kết tụ của chất kết tụ sinh học (Deng et al., 2002) Việc này đóng vai trò then chốt trong quá trình xác định dòng vi khuẩn có khả năng sản sinh kết tụ sinh học hiệu quả nhất.
Hình 3: Công thức cấu tạo kaolin
2.5.4 Các nhân tố ảnh hưởng đến khả năng kết tụ của vi khuẩn sản xuất chất kết tụ sinh học
Có nhiều nhân tố quyết định đến khả năng kết tụ của vi khuẩn sản xuất chất kết tụ sinh học:
Chất kết tụ sinh học, được hình thành từ vi sinh vật, có những đặc điểm, cấu trúc và khả năng kết tụ khác nhau tùy thuộc vào loại vi sinh vật sản sinh ra chúng (Nakamura et al., 1976).
Nguồn dinh dưỡng cho vi sinh vật phát triển tổng hợp kết tụ sinh học bao gồm carbon, nitrogen và khoáng vô cơ, đóng vai trò quyết định trong cấu trúc và các nhóm chức năng của phân tử kết tụ sinh học (Seng et al 2006).
Các điều kiện như pH, các ion, và liều lượng chất kết tụ sinh học có ảnh hưởng đáng kể đến điện tích và các cầu nối, từ đó kích thích quá trình kết tụ sinh học (Zang et al., 1999; Seng et al., 2006).
2.5.5 Vi sinh vật sản xuất chất kết tụ sinh học
Các thành phần chất kết tụ sinh học được sản xuất từ các nhóm vi khuẩn khác nhau, dẫn đến sự khác biệt về đặc tính và khả năng kết tụ của chúng (Nakamura et al., 1976) Nhiều giống vi khuẩn, chẳng hạn như Bacillus licheniformis sp (Hiroaki và Kiyoshi, 1985) và Nocardia amarae, có khả năng sản xuất các chất kết tụ sinh học này.
YK1 (Takeda et al., 1992) có khả năng sản xuất chất kết tụ sinh học là protein;
Alcaligenes latus KT201 (Toeda và Kurane, 1991), và Bacillus subtilis IFO3335
Yokoi et al (1996) demonstrated the ability to produce biopolymer aggregates in the form of polysaccharides Meanwhile, research by Lee et al (1995) on Arcuadendron sp TS-4 and Wang et al on Arathrobacter sp further contributes to the understanding of microbial polysaccharide production.
1995) có khả năng sản xuất chât kết tụ sinh học là glycoprotein
2.5.6 Ứng dụng vi khuẩn sản sinh chất kết tụ sinh học xử lý nước thải
Trong xử lý nước thải, chất kết tụ sinh học từ vi sinh vật, cùng với các chất lơ lửng vô cơ như bentonite, đất sét và Ca(OH)2, được sử dụng để xử lý dung dịch thuốc nhuộm và giảm các chỉ tiêu như COD và độ đục của nước thải Nhiều nghiên cứu hiện nay cho thấy vi khuẩn tạo chất kết tụ sinh học có hiệu quả trong việc xử lý nước và nước thải, cũng như trong công nghệ thực phẩm và hóa chất.
Theo nghiên cứu của Deng (2002), chất kết tụ sinh học MBFA9 từ Bacillus mucilaginosus có khả năng kết tụ 99,6% dung dịch Kaolin chỉ với 0,1ml/l MBFA9 chứa các thành phần chính như acid uronic (19,1%), đường trung tính (47,4%), và đường amino (2,7%) Phân tích quang phổ cho thấy sự hiện diện của các nhóm COOH và OH trong kết tụ sinh học Chất này không độc hại và có thể ứng dụng trong công nghệ thực phẩm để giảm hàm lượng chất lơ lửng Khi áp dụng trong xử lý nước thải tinh bột, MBFA9 hiệu quả trong việc lắng các vật thể hữu cơ nhỏ, đặc biệt với sự có mặt của muối Ca2+ Sau 5 phút lắng, MBFA9 có thể giảm TSS và COD lần lượt là 85,5% và 68,5% Bảng 6 chỉ ra rằng MBFA9 có hiệu quả vượt trội so với các chất kết tụ khác trong xử lý nước thải tinh bột.
Bảng 2: Kết quả xử lý nước thải tinh bột bởi các nhân tố kết tụ
Nhân tố kết tụ Liều lượng (mg/l) pH SS (mg/l) COD (mg/l) Đối chứng - 4,3 2145 6222
(PAC: poly aluminium chloride; PAM: nonionic polyacrylamide; HPAM: anionic polyacrylamide; MBFA9: kết tụ sinh học bởi B mucilaginosus)
Cánh đồng lọc chậm
Cánh đồng lọc chậm là hệ thống xử lý nước thải hiệu quả, sử dụng đất và thực vật với lưu lượng nước thải nạp khoảng vài cm mỗi tuần Quá trình xử lý diễn ra khi nước thải di chuyển qua đất và thực vật, trong đó một phần nước có thể thẩm thấu vào nước ngầm, một phần được cây cối hấp thụ, và một phần bốc hơi qua quá trình bốc hơi và hô hấp của thực vật Nếu được thiết kế chính xác, việc chảy tràn ra khỏi hệ thống sẽ được kiểm soát hoàn toàn.
Hình 4: Sơ đồ di chuyển của nước thải trong cánh đồng lọc chậm
Lưu lượng nạp cho hệ thống thay đổi từ 1,5 đến 10 cm/tuần, tùy thuộc vào loại đất và thực vật Đối với cây trồng sử dụng làm thực phẩm, cần khử trùng nước thải trước khi đưa vào hệ thống hoặc ngừng tưới nước thải ít nhất 1 tuần trước khi thu hoạch để đảm bảo an toàn cho sản phẩm Để thiết kế hệ thống này, cần áp dụng các công thức tính toán phù hợp.
Lh + Pp = ET + W + R +trong đó
Lh: lưu lượng nước thải nạp cho hệ thống (cm/tuần) Pp: lượng nước mưa (cm/tuần)
ET: lượng hơi nước bay hơi do quá trình bốc hơi nước và hô hấp của thực vật (cm/tuần)
W: lượng nước thấm qua đất (cm/tuần) R: lượng nước chảy tràn (cm/tuần) (= 0 nếu thiết kế chính xác)
I: khả năng thấm lọc của đất, mm P": ẩm độ cuối cùng của đất, % trọng lượng P': ẩm độ ban đầu của đất, % trọng lượng S: tỉ trọng của đất
D: bề dày của lớp đất ẩm do tưới nước thải
Sơ lược cỏ vetiver
2.6.1 Đặc điểm hình thái cỏ vetiver
- Cỏ Vetiver có bộ rễ đồ sộ, rất phát triển, mọc rất nhanh và ăn rất sâu, trong 12 tháng đã có thể ăn sâu tới 3,6m trên đất tốt
Cỏ Vetiver có bộ rễ sâu, giúp nó chịu hạn tốt và khả năng hút ẩm từ các tầng đất sâu Điều này cho phép cỏ xuyên qua các lớp đất bị nén chặt, từ đó giảm lượng nước thải thấm xuống quá sâu.
Bộ rễ khổng lồ của cây chủ yếu bao gồm các sợi rễ nhỏ và mịn với đường kính trung bình chỉ khoảng 0,5-1,0mm (Cheng et al., 2003) Điều này tạo ra một bầu rễ lớn, thuận lợi cho sự phát triển của vi khuẩn và nấm, từ đó giúp hấp thụ và phân hủy các chất gây ô nhiễm như nitơ.
Cỏ mọc thẳng đứng và cứng cáp, có thể cao tới 3m Khi trồng dày, chúng tạo thành hàng rào sống kín nhưng thoáng, giúp làm chậm dòng chảy của nước và hoạt động như một màng lọc, giữ lại bùn đất hiệu quả.
Hình 5: Cỏ vetiver http://www.eastsidepatch.com/2010/10/16005/usa-pl03/ (ngày 06/08/2012)
2.6.2 Đặc điểm sinh lý cỏ vetiver
- Cỏ Vetiver có thể thích nghi với đất có độ chua, độ mặn, độ phèn cao, có hàm lượng Na và Mg cao
Cỏ Vetiver có khả năng thích nghi với đất và nước có hàm lượng cao các kim loại nặng như Al, Mn, As, Cd, Cr, Ni, Pb, Hg, Se và Zn.
- Cỏ Vetiver có thể hấp thụ một lượng lớn N và P hòa tan trong nước thải
- Cỏ Vetiver có thể thích nghi với đất có hàm lượng chất dinh dưỡng cao
Cỏ Vetiver có khả năng phục hồi nhanh chóng sau khi trải qua các điều kiện khắc nghiệt như hạn hán, giá lạnh, cháy, nhiễm mặn và những yếu tố bất lợi khác, ngay khi những điều kiện này được cải thiện.
Sơ lược chi cỏ năng
Chi Cỏ năng (Eleocharis) thuộc họ Cói (Cyperaceae) bao gồm khoảng 200-250 loài, thường được gọi là cỏ/củ năn(g) Các loài cỏ năng chủ yếu là cỏ dại có thân đặc, sống thủy sinh, với lá suy giảm quanh gốc thân; các cấu trúc giống lá thực chất là thân, thực hiện chức năng quang hợp chính Nhiều loài có thân ngầm dưới nước và sử dụng cơ chế cố định carbon C3 Hoa của chúng mọc thành bông con dày đặc, phần lớn các loài phát triển từ thân rễ, trong khi một số có thân củ Hầu hết các loài có hình dạng tương tự, với cụm hoa ở đầu thân đơn Eleocharis phân bố rộng rãi trên toàn cầu, trong đó cỏ năng ống (Eleocharis dulcis) là một trong những loài nổi bật nhất.
PHƯƠNG TIỆN VÀ PHƯƠNG PHÁP NGHIÊN CỨU
Phương tiện thí nghiệm
- Nước rỉ rác được lấy từ bãi rác Tân Long tỉnh Hậu Giang
- Vi khuẩn khử đạm: Pseudomonas stutzeri D3b (Phòng Vi sinh vật đất, Viện Nghiên cứu và Phát triển Công nghệ Sinh học – Đại học Cần Thơ)
- Vi khuẩn tích lũy lân: Bacillus subtilis DTT1 (Phòng Vi sinh vật đất, Viện Nghiên cứu và Phát triển Công nghệ Sinh học – Đại học Cần Thơ)
- Vi khuẩn kết tụ sinh học: Enterobacter aerogenes dòng P11 (Phòng Vi sinh vật đất, Viện Nghiên cứu và Phát triển Công nghệ Sinh học – Đại học Cần Thơ)
3.1.2 Dụng cụ, trang thiết bị
Phòng Vi sinh vật đất thuộc Viện Nghiên cứu và Phát triển Công nghệ sinh học, Trường Đại học Cần Thơ sử dụng các dụng cụ và trang thiết bị nghiên cứu như ống nghiệm, tuýp Eppendorf và đĩa petri để thực hiện các thí nghiệm và phân tích vi sinh vật.
Cốc thủy tinh, bình tam giác các loại
Keo nhựa (dung tích 1 lít)
Máy Vortex, máy đo pH
Tủ sấy, tủ lạnh, tủ ủ
Tủ cấy vô trùng, tủ khử trùng nhiệt ướt
3.1.3.1 Môi trường nuôi vi khuẩn khử đạm
Bảng 3: Hóa chất pha 1 lít môi trường nuôi vi khuẩn khử đạm
Vi lượng: 2 ml/l môi trường (EDTA: 57,1 g/l, ZnSO4.7H2O: 3,9 g/l, CaCl2: 7 g/l, MnCl2.3H2O: 5,1 g/l, FeSO4.7H2O: 5,0 g/l, (NH4)6MoO29.7H2O: 1,1 g/l, CuSO4.5H2O: 1,6 g/l, CoCl2.5H2O: 1,6 g/l)
3.1.3.2 Môi trường nuôi vi khuẩn tích lũy lân
Bảng 4: Hóa chất pha 1 lít môi trường nuôi vi khuẩn tích lũy lân
Na2MoO4.2H2O: 0,06 g/l ZnSO4.7H2O: 0,12 g/l CoCl2.6H2O: 0,15 g/l Ethylene diamine tetraacetic acid (EDTA): 10 g/l
3.1.3.3 Môi trường nuôi vi khuẩn kết tụ sinh học protein
Bảng 5: Hóa chất pha 1 lít môi trường nuôi vi khuẩn kết tụ sinh học protein
3.1.3.4 Các hóa chất sử dụng để đo đạm
Dung dịch EDTA (C10H14N2O8Na2.2H2O - Ethylene diamine tetraacetic aicd disodium salt) hòa tan 6g EDTA với 100ml H2O
Dung dịch Phenol-sodium nitroprusside dihydrate : hòa tan 7g phenol (C6H5OH) và
0,034g sodium nitroprusside dihydrate (Na2(Fe(CN)5NO.2H2O) thêm nước đủ 100ml
(50ml H2O + phenol + sodium nitroprusside dihydrate + 50ml H2O), dung dịch này được bảo quản lạnh
Dung dịch Sodium hypochloride: hòa tan 4,98g Na2HPO4, 1,48g NaOH và 20ml
NaOCl thêm nước đủ 100ml
Dung dịch đạm chuẩn N-NH4 1 mg/l
3.1.3.5 Các hóa chất sử dụng để đo lân
Dung dịch A: 6g/l (NH4)Mo2O24.4H2O, 0,1454g/l KsbOC4H4O6, 500ml H2SO4 5N (70ml H2SO4 + 500ml H2O)
Dung dịch B: 200ml dung dịch A + 1,056g acid ascorbic
Dung dịch đạm chuẩn P-P2O5 10 mg/l
3.1.3.6 Các hóa chất sử dụng để keo tụ, lọc
Poly Aluminium Chloride ( PAC) polymer A – Anionic
Phương pháp nghiên cứu
3.2.1 Thí nghiệm 1: Keo tụ nước rỉ rác sau xử lý vi khuẩn khử Đạm, Lân
Mục đích: keo tụ nước rỉ rác đã qua quá trình xử lý vi khuẩn khử Đạm, Lân
Nước rỉ rác đã được xử lý bằng vi khuẩn khử đạm và lân từ thí nghiệm ứng dụng vi khuẩn trong mô hình bùn hoạt tính kết hợp với giá bám vi sinh vật, với thể tích 100 lít Nước được thu thập từ các nghiệm thức NT2 (Bùn hoạt tính) và NT3 (Bùn hoạt tính + Giá bám) vào ngày thứ 12 của thí nghiệm.
- Nuôi dòng vi khuẩn kết tụ sinh học
+ Mỗi dòng vi khuẩn được nuôi trong 50ml môi trường lỏng trong bình tam giác 100ml (môi trường dùng để phân lập không bổ sung agar)
+ Lắc bằng máy lắc 150 vòng/phút
+ Nuôi trong 3 ngày ở nhiệt độ phòng cho vi khuẩn phát triển sản sinh kết tụ sinh học và được sử dụng cho các thí nghiệm sau
- Chuẩn bị keo nhựa và hóa chất keo tụ (PAC, Polymer)
Bảng 6: Bố trí thí nghiệm 1
Nghiệm thức Phương pháp keo tụ Thể tích Số lần lặp
Vi khuẩn kết tụ (1ml/L) PAC (2,5g/L)
Nghiệm thức 4 PAC (2,5g/L) + Polymer (0,01g/L) 5 lít 3 lần
Nghiệm thức 5 PAC (2,5g/L) + Vi khuẩn kết tụ (1ml/L) 5 lít 3 lần
Nghiệm thức 1 bao gồm việc xử lý nước rỉ rác bằng vi khuẩn để khử đạm và lân Sau đó, nước được cho vào keo nhựa và để yên trong 30 phút trước khi thu mẫu để phân tích các chỉ tiêu cần thiết.
Nghiệm thức 2 bao gồm việc sử dụng nước đã qua xử lý vi khuẩn để khử đạm và lân, sau đó cho vào keo nhựa 5 lít Tiếp theo, thêm 1ml vi khuẩn kết tụ vào mỗi lít nước, khuấy đều trong 1 phút và để yên trong 30 phút để quá trình kết tụ diễn ra Cuối cùng, thu phần nước trong để tiến hành phân tích các chỉ tiêu.
Nghiệm thức 3 bao gồm việc xử lý nước đã qua quá trình khử vi khuẩn, sau đó cho vào keo nhựa 5 lít Tiếp theo, thêm PAC với tỷ lệ 2,5g/L và khuấy đều trong 5 phút Sau đó, để yên trong 30 phút để tiến hành quá trình keo tụ, cuối cùng thu phần nước trong để phân tích các chỉ tiêu.
Nghiệm thức 4 bao gồm việc xử lý nước đã qua quá trình khử vi khuẩn, sau đó cho vào keo nhựa 5 lít Tiếp theo, thêm PAC với tỷ lệ 2,5g/L và khuấy đều trong 5 phút Sau đó, thêm Polymer với tỷ lệ 0,01g/L và khuấy tiếp trong 1 phút Cuối cùng, để yên trong 30 phút cho quá trình keo tụ diễn ra, sau đó thu phần nước trong để phân tích các chỉ tiêu.
Nghiệm thức 5 bao gồm việc sử dụng nước đã qua xử lý khuẩn khử Đạm và Lân, được cho vào keo nhựa 5 lít Tiếp theo, thêm PAC với tỷ lệ 2,5g/L và khuấy đều trong 5 phút Sau đó, bổ sung vi khuẩn kết tụ với tỷ lệ 1ml/L, khuấy tiếp trong 1 phút và để yên trong 30 phút để quá trình keo tụ diễn ra Cuối cùng, thu phần nước trong để tiến hành phân tích các chỉ tiêu.
Tất cả các nghiệm thức đều được lặp lại 3 lần
Các chỉ tiêu cần phân tích: pH, NH 4 , PO 4 3- , COD, TKN, TP, TSS
3.2.3 Thí nghiệm 2: Lọc nước sau keo tụ xử lý ở thí nghiệm 1
Mục đích : Loại bỏ các tạp chất còn sót lại
- Thu nước sau keo tụ xử lý ở nghiệm thức cho kết quả tốt nhất trong thí nghiệm 1
- Cỏ Vetiver và Năng trồng trong cát ở thùng dung tích 10 lít
- Thùng dung tích 10 lít có vòi dưới xả nước
Bảng 7: Bố trí thí nghiệm 2
Nghiệm thức Phương pháp lọc Lưu lượng Số lần lặp
Nghiệm thức 1 Đối chứng 2 lít/ngày 3 lần
Nghiệm thức 2 Cát 2 lít/ngày 3 lần
Nghiệm thức 3 Than hoạt tính 2 lít/ngày 3 lần
Nghiệm thức 4 Cỏ Vetiver trồng trong cát 2 lít/ngày 3 lần
Nghiệm thức 5 Cỏ Năng trồng trong cát 2 lít/ngày 3 lần
Trong thí nghiệm này, chúng tôi thực hiện 5 nghiệm thức, mỗi nghiệm thức được lặp lại 3 lần Lưu lượng lọc được duy trì ở mức 2 lít/ngày và quá trình theo dõi kéo dài trong 10 ngày Sau thời gian này, chúng tôi tiến hành thu thập nước qua quá trình lọc để phân tích các chỉ tiêu vào ngày thứ 10.
- Nghiệm thức 1: Nước sau keo tụ xử lý ở thí nghiệm 1 sử dụng làm nguồn nước châm
Trong Nghiệm thức 2, 10kg cát được cho vào thùng có dung tích 10 lít và có vòi dưới để xả nước Nước sau khi xử lý keo tụ từ Thí nghiệm 1 sẽ được bổ sung vào thùng với lượng 2 lít mỗi ngày.
Nghiệm thức 3 thực hiện bằng cách cho 2kg than hoạt tính vào thùng dung tích 10 lít có vòi dưới để xả nước Nước sau quá trình xử lý keo tụ từ thí nghiệm 1 sẽ được cho vào với lưu lượng 2 lít mỗi ngày.
- Nghiệm thức 4: Nước sau keo tụ xử lý từ thí nghiệm 1 cho vào mô hình lọc cỏ vetiver trồng trong cát lưu lượng 2 lít/ngày
- Nghiệm thức 5: Nước sau keo tụ xử lý từ thí nghiệm 1 cho vào mô hình lọc cây năng trồng trong cát lưu lượng 2 lít/ngày.
Phương pháp phân tích các chỉ tiêu hóa lý
Tiến hành theo dõi pH trong tất cả các nghiệm thức mỗi ngày bằng máy đo pH:
Hiệu chỉnh pH về giá trị trung tính (pH = 7) bằng các dung dịch pH chuẩn
Để thực hiện nghiệm thức, lấy khoảng 5ml mẫu và rót vào ly nhựa để tránh nhiễm chéo Đặt điện cực của điện kế vào mẫu cần đo và ghi lại kết quả Sau mỗi lần đo, cần rửa sạch điện cực bằng nước cất và lau khô bằng giấy mềm.
3.3.2 Đo đạm theo phương pháp Indophenol Blue
Mỗi ngày, tiến hành đo nồng độ ammonium trong tất cả các nghiệm thức của thí nghiệm Để đánh giá khả năng khử đạm của các chủng vi khuẩn, xác định hàm lượng NH4+ trong môi trường bằng phương pháp so màu trên máy quang phổ kế Spectrophotometer ở bước sóng 636 nm, theo phương pháp Indophenol Blue (Keeney Nelson, 1982).
NH4 + + Phenol Hypochloride ion (môi trường kiềm) Indophenol (có màu xanh)
Các bước tiến hành đo đạm:
Để tạo dãy đường chuẩn, đầu tiên, chuẩn bị 6 ống nghiệm 20ml và thêm lần lượt 2,5; 2; 1,5; 1; 0,5; 0 ml nước cất vào các ống nghiệm được đánh số từ 0 đến 5 Tiếp theo, cho 0; 0,5; 1; 1,5; 2; 2,5 ml dung dịch đạm chuẩn có hàm lượng 1 mg/l N-NH4 + vào từng ống Sau đó, thêm 0,5 ml dung dịch EDTA, 1 ml dung dịch Phenol-Sodium nitroprusside và 2 ml dung dịch Sodium hypochloride vào mỗi ống, rồi trộn đều bằng máy Vortex Kết quả thu được là dãy đường chuẩn với hàm lượng NH4 + trong các ống theo thứ tự tăng dần là 0-1-2-3-4-5 mg/l.
Bảng 8: Thành phần của dãy đường chuẩn NH 4 +
Hóa chất Ống 0 Ống 1 Ống 2 Ống 3 Ống 4 Ống 5
Dung dịch NH4 + chuẩn (1 mg/l) 0 ml 0,5 ml 1 ml 1,5 ml 2 ml 2,5 ml Nước khử khoáng 2,5 ml 2 ml 1,5 ml 1 ml 0,5 ml 0 ml
Để thực hiện quy trình, đầu tiên hút 2 ml nước cất và 0,5 ml dung dịch mẫu nước thải, sau đó ly tâm ở tốc độ 10.000 vòng/phút trong 5 phút Tiếp theo, thêm lần lượt 0,5 ml dung dịch EDTA, 1 ml dung dịch Phenol-Sodium nitroprusside và 2 ml dung dịch Sodium hypochloride vào mỗi ống, sau đó trộn đều bằng máy Vortex Cuối cùng, để ổn định hỗn hợp trong khoảng 15 – 20 phút ở nhiệt độ phòng.
Trước khi tiến hành đo hàm lượng NH4 +, hãy bật máy quang phổ khoảng 30 phút Hàm lượng NH4 + được xác định bằng cách đo cường độ hấp thu màu (OD) tại bước sóng 636 nm Đầu tiên, đo giá trị OD ở 6 ống nghiệm có hàm lượng NH4 + đã biết, sau đó tiếp tục đo OD cho các nghiệm thức khác.
Để tiến hành đo độ hấp thụ quang (OD), sử dụng giá trị OD của ống số 0 (không có NH4+ và không có màu xanh) làm mẫu blank để đưa giá trị OD về 0 Sau đó, thực hiện đo OD cho 5 ống nghiệm còn lại, bao gồm ống nghiệm 1, 2, và các ống nghiệm tiếp theo.
3, 4, 5 lần lượt có giá trị NH4 + là 1, 2, 3, 4, 5 mg/l có màu xanh đậm dần sẽ tương ứng với
5 giá trị OD tăng dần
Sử dụng phần mềm Excel để thiết lập phương trình đường chuẩn NH4 +
Dựa vào phương trình đường chuẩn: A = a*C + b
Trong đó: C là hàm lượng đạm của mẫu (mg/l)
A là độ hấp thụ quang (OD636nm)
Dựa vào phương trình đường chuẩn của ion NH4+ và giá trị OD636nm của mẫu, bạn có thể tính hàm lượng đạm trong mẫu tương ứng với lượng NH4+ bằng công thức: C = (A – b)/a.
Để dựng dãy đường chuẩn gồm 6 ống nghiệm 20ml, cho 6 ml nước khử khoáng vào mỗi ống nghiệm Hút lần lượt 2,5; 2; 1,5; 1; 0,5; và 0 ml nước khử khoáng vào các ống nghiệm được đánh số từ 0 đến 5 Tiếp theo, thêm lần lượt 0; 0,5; 1; 1,5; 2; và 2,5 ml dung dịch lân chuẩn với hàm lượng 10 mg/l P-P2O5 Sau đó, bổ sung 4ml dung dịch B vào mỗi ống nghiệm và trộn đều bằng máy Vortex Ống nghiệm đầu tiên sẽ là mẫu blank, tạo ra dãy chuẩn với hàm lượng P2O5 theo thứ tự tăng dần là 0-10-20-30-40-50 mg/l.
Bảng 9: Thành phần của dãy đường chuẩn P 2 O 5
Hóa chất Ống 0 Ống 1 Ống 2 Ống 3 Ống 4 Ống 5
Dung dịch P2O5 chuẩn (10 mg/l) 0 ml 0,5 ml 1 ml 1,5 ml 2 ml 2,5 ml Nước khử khoáng 2,5 ml 2 ml 1,5 ml 1 ml 0,5 ml 0 ml Dung dịch B 4 ml
Để đo mẫu nước thải, bạn cần chuẩn bị 8 ml nước cất và 0,5 ml dung dịch mẫu nước thải Tiếp theo, thêm 4 ml dung dịch B vào mỗi ống nghiệm và trộn đều bằng máy Vortex Cuối cùng, để dung dịch ổn định trong 20 phút ở nhiệt độ phòng.
Tiến hành đo lân trong mẫu ở bước sóng 880nm
Sử dụng phần mềm Excel vẽ đồ thị xác định phương trình đường chuẩn của P2O5 Phương trình đường chuẩn có dạng: Y = a*X + b
Trong đó: X là nồng độ của mẫu (mg/l)
Y là độ hấp thụ quang (OD880nm)
Dựa vào phương trình đường chuẩn P2O5 và giá trị OD880nm của mẫu để tính hàm lượng lân có trong mẫu tương ứng với lượng P2O5 theo công thức: X = (Y – b)/a
Từ hàm lượng lân có trong mẫu tương ứng với hàm lượng P2O5, tính hàm lượng
PO4 3- dựa theo công thức:
(Trong đó: C là hàm lượng Lân có trong mẫu tương ứng với hàm lượng P2O5
3.3.4 Tổng đạm (TKN) và tổng lân (TP) (phương pháp Kjeldahl)
Các dạng đạm hữu cơ khi bị oxy hóa bởi acid H2SO4 đậm đặc với sự có mặt của xúc tác K2SO4 và CuSO4 hoặc H2O2 ở nhiệt độ cao (375-385 o C) sẽ được chuyển hóa hoàn toàn thành đạm ammonium (NH4+) Đồng thời, ammonia (NH3) cũng sẽ chuyển đổi thành ammonium Khi thêm dung dịch bazơ, ammonia sẽ hòa tan trong môi trường kiềm và bị hấp thu.
Mối quan hệ giữa acid boric, acid sulfuric và ammonia có thể được xác định thông qua phương pháp so màu quang phổ Indophenol blue Các dạng lân hữu cơ cũng sẽ bị oxy hóa trong điều kiện tương tự như đạm hữu cơ, chuyển hóa thành orthophosphate Để xác định orthophosphate, có thể sử dụng phương pháp so màu quang phổ với ascorbic acid hoặc xanh molypden.
Để phân tích tổng đạm (TKN) và tổng lân (TP), chúng ta có thể thực hiện công phá trên cùng một mẫu Sau đó, tiến hành phân tích hai chỉ tiêu này bằng các phương pháp phân tích các dạng muối đạm và lân vô cơ hòa tan.
Phương pháp đo tổng đạm
Khi đun mẫu vật chứa nitơ trong H2SO4 đậm đặc với chất xúc tác thích hợp, các hợp chất hữu cơ sẽ bị oxy hóa, tạo ra CO2 và H2O từ carbon và hydro Nitơ được phóng thích dưới dạng NH3, sau đó kết hợp với H2SO4 để hình thành muối (NH4)2SO4 tan trong dung dịch.
Hợp chất chứa nitơ (N) (NH4)2SO4
The process involves distilling and removing nitrogen from the solution of (NH4)2SO4 as ammonia (NH3) using sodium hydroxide (NaOH) The released ammonia is then absorbed by a boric acid (H3BO3) solution, utilizing a color indicator made from a mixture of bromcresol green and methyl red, resulting in the formation of ammonium tetraborate salt.
(NH4)2SO4 + 2NaOH → Na2SO4 + 2NH3 + 2H2O 2NH3 + 4H3BO3 → (NH4)2B4O7 + 5H2O
Sau đó định phân lượng nitơ trong dung dịch (NH4)2B4O7 bằng dung dịch acid mạnh H2SO4 0,05N (chuẩn) đến khi dung dịch chuyển từ màu xanh sang màu đỏ nâu
(NH4)2B4O7 + H2SO4 + 5H2O → (NH4)2SO4 + 4H3BO3
Chất xúc tác vô cơ hóa mẫu: Nghiền mịn và trộn đều theo tỉ lệ như sau: 100g K2SO4: 10g CuSO4: 1g Se
Hỗn hợp chất chỉ thị màu: Cân 0,099 bromoresol green và 0,666g methyl red hòa tan trong 100 ml ethanol
H2SO4 đđ, xúc tác, nhiệt độ
Dung dịch acid boric có thể được chuẩn bị bằng cách hòa tan 20g acid boric (H3BO3) trong 950 ml nước cất, sau đó thêm 20 ml dung dịch chất chỉ thị màu và điều chỉnh thể tích lên 1 lít bằng nước cất, tạo ra dung dịch có màu đỏ Để điều chỉnh màu sắc của dung dịch về màu đỏ nâu gần chuyển sang màu xanh (pH 5), sử dụng dung dịch NaOH 0,1N (Bremner, 1970).
Dung dịch NaOH 10N: Cân 400g NaOH hòa tan trong nước cất cho vừa đủ 1 lít chứa trong bình kín hạn chế tiếp xúc khí CO2
Thí nghiệm 1: Keo tụ nước rỉ rác sau xử lý vi khuẩn khử đạm, lân
4.1.1 Ảnh hưởng của PAC, Polymer và vi khuẩn Enterobacter aerogenes dòng P11 đến pH nước rỉ rác
NT1 NT2 NT3 NT4 NT5
Hình 7: Ảnh hưởng của PAC, Polymer và vi khuẩn Enterobacter aerogenes dòng P11 đến pH nước rỉ rác
Ghi chú: NT1 = Đối chứng; NT2 = Vi khuẩn Enterobacter aerogenes dòng P11 1ml/L; NT3 = PAC 2,5g/L;
NT 4 = PAC 2,5g/L+polymer 0,01g/L; NT 5 = PAC 2,5g/L+Vi khuẩn Enterobacter aerogenes dòng P11 1ml/L
Sau khi kết thúc quá trình thí nghiệm, độ pH của nghiệm thức NT2 [Vi Khuẩn Enterobacter aerogenes dòng P11 1ml/L] là 7,35, gần như tương đương với nghiệm thức NT1 [Đối chứng] có pH 7,33 Trong khi đó, các nghiệm thức NT3 [PAC 2,5g/L] và NT4 [PAC 2,5g/Lít + polymer 0,01g/L] có pH lần lượt là 6,52 và 6,53, còn nghiệm thức NT5 [PAC 2,5g/L + Vi khuẩn Enterobacter aerogenes dòng P11 1ml/L] có pH 6,67 Mặc dù ba nghiệm thức này không khác biệt có ý nghĩa thống kê, nhưng so với nghiệm thức NT1, chúng có sự khác biệt ở mức ý nghĩa 1% Điều này cho thấy việc sử dụng PAC trong quá trình keo tụ đã làm giảm pH của nước, nhưng vẫn nằm trong mức cho phép.
4.1.2 Ảnh hưởng của PAC, Polymer và vi khuẩn Enterobacter aerogenes dòng P11 đến hàm lượng ammonium trong nước rỉ rác
NT1 NT2 NT3 NT4 NT5
Hà m l ượ ng am m o ni u m ( m g/ L)
Hình 8: Ảnh hưởng của PAC, Polymer và vi khuẩn Enterobacter aerogenes dòng P11 đến hàm lượng ammonium trong nước rỉ rác
Ghi chú: NT1 = Đối chứng; NT2 = Vi khuẩn Enterobacter aerogenes dòng P11 1ml/L; NT3 = PAC 2,5g/L; NT4 = PAC 2,5g/L+polymer 0,01g/L; NT5 = PAC 2,5g/L+Vi khuẩn Enterobacter aerogenes dòng P11 1ml/L
Sau quá trình thí nghiệm, hàm lượng ammonium trong nước của các nghiệm thức đều tăng so với nghiệm thức NT1 [Đối chứng] là 30,69 mg/L Nghiệm thức NT2 [Vi khuẩn Enterobacter aerogenes dòng P11 1ml/Lít] có hàm lượng ammonium là 32,9 mg/L, không khác biệt có ý nghĩa thống kê so với NT1 Các nghiệm thức còn lại đều khác biệt ở mức ý nghĩa 1% so với NT1 Nghiệm thức NT3 [PAC 2,5g/L] ghi nhận hàm lượng ammonium cao nhất là 42,61 mg/L, cho thấy PAC có tác dụng làm tăng hàm lượng ammonium nhưng không đáng kể Nghiệm thức NT4 [PAC 2,5g/L+polymer 0,01g/L] có hàm lượng 40,51 mg/L, không khác biệt có ý nghĩa thống kê so với NT3 và NT5 [PAC 2,5g/L+Vi khuẩn Enterobacter aerogenes dòng P11 1ml/Lít].
38,68 mg/L thấp hơn so với nghiệm thức NT3 [PAC 2,5g/L], cho thấy việc kết hợp vi
CV (%)= 4,52 khuẩn Enterobacter aerogenes dòng P11 với PAC hạn chế sự tăng hàm lượng ammonium trong nước khi sử dụng PAC
4.1.3 Ảnh hưởng của PAC, Polymer và vi khuẩn Enterobacter aerogenes dòng P11 đến hàm lượng PO 4 3- trong nước rỉ rác
NT1 NT2 NT3 NT4 NT5
Hình 9: Ảnh hưởng của PAC, Polymer và vi khuẩn Enterobacter aerogenes dòng P11 đến hàm lượng PO 4 3- trong nước rỉ rác
Ghi chú: NT1 = Đối chứng; NT2 = Vi khuẩn Enterobacter aerogenes dòng P11 1ml/L; NT3 = PAC 2,5g/L; NT4 = PAC 2,5g/L+polymer 0,01g/L; NT5 = PAC 2,5g/L+Vi khuẩn Enterobacter aerogenes dòng P11 1ml/L
Sau khi kết thúc quá trình thí nghiệm, hàm lượng PO4 3- trong nước của các nghiệm thức đều giảm so với nghiệm thức NT1 (Đối chứng) là 32,25 mg/L Kết quả kiểm định LSD0,01 cho thấy nghiệm thức NT2 (Vi khuẩn Enterobacter aerogenes dòng P11 1ml/L) có hàm lượng 30,61 mg/L, không khác biệt có ý nghĩa thống kê so với nghiệm thức NT1 Nghiệm thức NT3 (PAC 2,5g/L) có hàm lượng 0,17 mg/L và nghiệm thức NT5 (PAC 2,5g/L + Vi khuẩn Enterobacter aerogenes dòng P11 1ml/L) là 0,13 mg/L cũng không khác biệt có ý nghĩa thống kê Các nghiệm thức còn lại đều có sự khác biệt có ý nghĩa thống kê ở mức 1%.
Enterobacter aerogenes dòng P11 1ml/L] sự giảm hàm lượng PO4 3- trong nước là cao
[PAC 2,5g/L+Vi khuẩn Enterobacter aerogenes dòng P11 1ml/L] cho thấy giai đoạn keo tụ xử lý tốt hàm lượng PO4 3- trong nước
4.1.4 Ảnh hưởng của PAC, Polymer và vi khuẩn Enterobacter aerogenes dòng P11 đến hàm lượng COD trong nước rỉ rác
NT1 NT2 NT3 NT4 NT5
Hình 10: Ảnh hưởng của PAC, Polymer và vi khuẩn Enterobacter aerogenes dòng P11 đến hàm lượng COD trong nước rỉ rác
Ghi chú: NT1 = Đối chứng; NT 2 = Vi khuẩn Enterobacter aerogenes dòng P11 1ml/L; NT 3 = PAC 2,5g/L;
NT 4 = PAC 2,5g/L+Polymer 0,01g/L; NT 5 = PAC 2,5g/L+Vi khuẩn Enterobacter aerogenes dòng P11 1ml/L
Sau khi kết thúc thí nghiệm, hàm lượng COD ở tất cả các nghiệm thức đều giảm so với nghiệm thức đối chứng NT1 (760 mg/L) Kiểm định LSD0,01 cho thấy sự khác biệt có ý nghĩa thống kê ở mức 1% giữa các nghiệm thức Nghiệm thức NT3 (PAC 2,5g/L) đạt hàm lượng COD thấp nhất là 337 mg/L, tiếp theo là NT5 (PAC 2,5g/L + Vi khuẩn Enterobacter aerogenes dòng P11 1ml/L) với 373 mg/L và NT4 (PAC 2,5g/L + Polymer 0,01g/L) với 407 mg/L Nghiệm thức NT2 (Vi khuẩn Enterobacter aerogenes dòng P11 1ml/L) có hàm lượng COD giảm ít nhất, đạt 723 mg/L.
Kết quả cho thấy quá trình keo tụ bằng PAC hiệu quả trong việc xử lý hàm lượng COD Tuy nhiên, khi kết hợp PAC với chất trợ keo tụ Polymer hoặc vi khuẩn Enterobacter aerogenes dòng P11, khả năng xử lý COD giảm so với việc chỉ sử dụng PAC.
CV (%)= 1,71 nhiều Vi khuẩn Enterobacter aerogenes dòng P11 xử lý hàm lượng COD kém không bằng các nghiệm thức có sử dụng PAC
4.1.5 Ảnh hưởng của PAC, Polymer và vi khuẩn Enterobacter aerogenes dòng P11 đến hàm lượng tổng chất rắn lơ lửng (TSS) trong nước rỉ rác
NT1 NT2 NT3 NT4 NT5
Hình 11: Ảnh hưởng của PAC, Polymer và vi khuẩn Enterobacter aerogenes dòng P11 đến hàm lượng TSS trong nước rỉ rác
Ghi chú: NT1 = Đối chứng; NT2 = Vi khuẩn Enterobacter aerogenes dòng P11 1ml/L; NT3 = PAC 2,5g/L; NT4 = PAC 2,5g/L+Polymer 0,01g/L; NT5 = PAC 2,5g/L+Vi khuẩn Enterobacter aerogenes dòng P11 1ml/L
Sau khi kết thúc thí nghiệm, hàm lượng tổng chất rắn lơ lửng (TSS) ở tất cả các nghiệm thức đều giảm so với nghiệm thức đối chứng NT1 (519 mg/L) Kiểm định LSD0,01 cho thấy TSS ở tất cả các nghiệm thức khác biệt có ý nghĩa thống kê ở mức 1% Nghiệm thức NT3 (PAC 2,5g/L) đạt hàm lượng TSS thấp nhất là 123 mg/L, tiếp theo là NT4 (PAC 2,5g/L + polymer 0,01g/L) và NT5 (PAC 2,5g/L + vi khuẩn Enterobacter aerogenes dòng P11 1ml/L) với hàm lượng TSS lần lượt cao hơn.
136 mg/L và 159 mg/L và hàm lượng TSS giảm ít nhất ở nghiệm thức NT2 [Vi khuẩn
Enterobacter aerogenes dòng P11 1ml/L] là 429 mg/L
Qua kết quả trên, cho thấy nếu chỉ sử dụng vi khuẩn Enterobacter aerogenes dòng
CV (%)= 4,04 chưa hiệu quả cao Quá trình keo tụ cần có PAC hay PAC kết hợp với Polymer, vi khuẩn
Enterobacter aerogenes dòng P11 để xử lý tốt hàm lượng tổng chất rắn lơ lửng
4.1.6 Ảnh hưởng của PAC, Polymer và vi khuẩn Enterobacter aerogenes dòng P11 đến hàm lượng phospho tổng (TP) trong nước rỉ rác
NT1 NT2 NT3 NT4 NT5
Hình 12: Ảnh hưởng của PAC, Polymer và vi khuẩn Enterobacter aerogenes dòng P11 đến hàm lượng phospho tổng (TP) trong nước rỉ rác
Ghi chú: NT1 = Đối chứng; NT2 = Vi khuẩn Enterobacter aerogenes dòng P11 1ml/L; NT3 = PAC 2,5g/L; NT4 = PAC 2,5g/L+Polymer 0,01g/L; NT5 = PAC 2,5g/L+Vi khuẩn Enterobacter aerogenes dòng P11 1ml/L
Kết quả thí nghiệm cho thấy hàm lượng TP trong nước rỉ rác giảm so với nghiệm thức NT1 (Đối chứng) là 16,1 mg/L Theo kiểm định LSD0,01, các nghiệm thức NT3 (PAC 2,5g/L), NT4 (PAC 2,5g/L + Polymer 0,01g/L) và NT5 (PAC 2,5g/L + Vi khuẩn Enterobacter aerogenes dòng P11 1ml/L) không có sự khác biệt có ý nghĩa thống kê Trong khi đó, các nghiệm thức khác đều thể hiện sự khác biệt có ý nghĩa thống kê ở mức 1% Các nghiệm thức NT3, NT4 và NT5 đều cho hàm lượng TP thấp nhất.
Nồng độ của vi khuẩn Enterobacter aerogenes dòng P11 trong nghiệm thức NT 1 lần lượt là 3,7 mg/L, 3,6 mg/L và 4,2 mg/L Trong khi đó, nghiệm thức NT 2 cho thấy nồng độ cao hơn là 12,6 mg/L Tuy nhiên, so với các nghiệm thức NT3, NT4 và NT5, hiệu quả của NT 2 không cao bằng, mặc dù vẫn thể hiện tiềm năng.
CV (%)= 5,14 việc sử dụng PAC hay PAC kết hợp với Polymer, vi khuẩn Enterobacter aerogenes dòng P11 đều cho kết quả tốt
4.1.7 Ảnh hưởng của PAC, Polymer và vi khuẩn Enterobacter aerogenes dòng P11 đến hàm lượng Nitơ tổng (TKN) trong nước rỉ rác
NT1 NT2 NT3 NT4 NT5
Hình 13: Ảnh hưởng của PAC, Polymer và vi khuẩn Enterobacter aerogenes dòng P11 đến hàm lượng Nitơ tổng (TKN) trong nước rỉ rác
Ghi chú: NT1 = Đối chứng; NT2 = Vi khuẩn Enterobacter aerogenes dòng P11 1ml/L; NT3 = PAC 2,5g/L; NT4 = PAC 2,5g/L+polymer 0,01g/L; NT5 = PAC 2,5g/L+Vi khuẩn Enterobacter aerogenes dòng P11 1ml/L
Sau khi kết thúc thí nghiệm, hàm lượng TKN trong nước ở tất cả các nghiệm thức đều giảm so với nghiệm thức đối chứng NT1 (46,8 mg/L) Nghiệm thức NT5 (PAC 2,5g/L + Vi khuẩn Enterobacter aerogenes dòng P11 1ml/L) ghi nhận hàm lượng TKN thấp nhất là 20,4 mg/L Kiểm định LSD0,01 cho thấy nghiệm thức NT2 (Vi khuẩn Enterobacter aerogenes dòng P11 1ml/L) có hàm lượng TKN 45,7 mg/L không khác biệt có ý nghĩa thống kê so với nghiệm thức NT1 Các nghiệm thức NT3 (PAC 2,5g/L), NT4 (PAC 2,5g/L + polymer 0,01g/L) và NT5 cũng cho thấy sự giảm hàm lượng TKN đáng kể.
Enterobacter aerogenes dòng P11 1ml/L] hàm lượng TKN lần lượt là 21,6 mg/L, 22,7 mg/L và 20,4 mg/L khác biệt không ý nghĩa thống kê so với nhau Các nghiệm thức còn
Kết quả trên cho thấy, việc sử dụng PAC hay PAC kết hợp Polymer, Vi khuẩn
Enterobacter aerogenes dòng P11 có thể xử lý tốt một phần hàm lượng Nitơ tổng
Hình 14: Hình sau khi keo tụ 30 phút của các nghiệm thức
Ghi chú: NT1 = Đối chứng; NT2 = Vi khuẩn Enterobacter aerogenes dòng P11 1ml/L; NT3 = PAC 2,5g/L; NT4 = PAC 2,5g/L+polymer 0,01g/L; NT5 = PAC 2,5g/L+Vi khuẩn Enterobacter aerogenes dòng P11 1ml/L
Trong thí nghiệm với thể tích 5 Lít, nghiệm thức NT 4 [PAC 2,5g/L + polymer 0,01g/L] tạo ra bông cặn lớn hơn so với các nghiệm thức khác Nghiệm thức NT 5 [PAC 2,5g/L + Vi khuẩn Enterobacter aerogenes dòng P11 1ml/L] cho thấy sự kết hợp giữa vi khuẩn Enterobacter aerogenes dòng P11 và PAC tạo ra bông cặn lớn hơn và thời gian lắng nhanh hơn so với nghiệm thức NT 3 [PAC 2,5g/L] Nghiệm thức NT 2 chỉ sử dụng vi khuẩn.
Enterobacter aerogenes dòng P11 1ml/L] không khác biệt so với nghiệm thức đối chứng
Thí nghiệm 1 cho thấy, với thể tích 5 lít mỗi đơn vị thí nghiệm, việc sử dụng PAC kết hợp với vi khuẩn Enterobacter aerogenes dòng P11 tạo ra bông cặn lớn và thời gian lắng nhanh hơn so với chỉ sử dụng PAC Tuy nhiên, hiệu quả này vẫn chưa đạt được mức cao như khi kết hợp PAC với chất trợ keo tụ Polymer Việc sử dụng vi khuẩn Enterobacter aerogenes dòng P11 trong quá trình này góp phần cải thiện chất lượng lắng.
Nghiên cứu cho thấy nghiệm thức NT5 (PAC 2,5g/L kết hợp với vi khuẩn Enterobacter aerogenes dòng P11 1ml/L) mang lại hiệu quả tốt trong việc xử lý nước, đồng thời ít tốn kém và thân thiện với môi trường hơn so với chất trợ keo tụ Polymer Các kết quả kiểm nghiệm mẫu nước xác nhận rằng nghiệm thức PAC kết hợp với vi khuẩn Enterobacter aerogenes dòng P11 sẽ được áp dụng cho thí nghiệm lọc nước tiếp theo sau quá trình keo tụ.
Thí nghiệm 2: Lọc nước sau keo tụ xử lý ở thí nghiệm 1
4.2.1 Ảnh hưởng của quá trình lọc nước sau keo tụ đến độ pH nước rỉ rác
4.2.1.1 Ảnh hưởng của quá trình lọc nước sau keo tụ của các nghiệm thức đến pH nước rỉ rác
Bảng 10: Ảnh hưởng của quá trình lọc nước sau keo tụ của các nghiệm thức đến pH nước rỉ rác
NT4: Cỏ Vetiver trồng trong cát
NT5: Cỏ Năng trồng trong cát
Theo bảng 10, độ pH của nghiệm thức NT3 (Than hoạt tính) cao hơn so với nghiệm thức NT1 (Đối chứng), trong khi các nghiệm thức khác đều ghi nhận sự giảm độ pH so với nghiệm thức NT1.
NT1 [Đối chứng] Qua kiểm định LSD0,01 cho thấy nghiệm thức NT2 [Cát] và NT5 [Cỏ
Năng trồng trong cát] khác biệt không ý nghĩa thống kê, các nghiệm thức còn lại đều khác biệt có ý nghĩa thống kê ở mức 1%
4.2.1.2 Ảnh hưởng của quá trình lọc nước sau keo tụ đến độ pH nước rỉ rác theo thời gian
Hình 15: Ảnh hưởng của quá trình lọc nước rỉ rác sau keo tụ đến pH nước rỉ rác theo thời gian
Giá trị pH được ghi nhận trong khoảng từ 7,3 đến 7,7, với sự biến đổi rõ rệt qua các ngày Cụ thể, pH giảm xuống 7,26 vào ngày thứ 2, sau đó tăng lên 7,50 vào ngày thứ 4, và tiếp tục giảm xuống 7,28 vào ngày thứ 5 Các giá trị pH trong ngày thứ 6 và 7 tương tự như ngày thứ 4 và 5.
Trong suốt 10 ngày theo dõi, giá trị pH của nước rỉ rác đã tăng dần, đạt 7,71 vào ngày thứ 10 Kết quả này cho thấy mặc dù giá trị pH có sự biến động, nhưng vẫn nằm trong khoảng cho phép.
4.2.1.3 Ảnh hưởng của quá trình lọc nước sau keo tụ của các nghiệm thức đến độ pH nước rỉ rác theo thời gian
Thời gian (ngày) pH ĐC NT2 NT3 NT4 NT5
Hình 16: Sự thay đổi pH nước rỉ rác của các nghiệm thức theo thời gian
Ghi chú: NT1 = Đối chứng; NT2 = Cát; NT3 = Than hoạt tính; NT4 = Cỏ Vetiver trồng trong cát; NT5 = Cỏ Năng trồng trong cát
Sau khi kết thúc quá trình thí nghiệm, pH ở các nghiệm thức dao động từ 7,0 đến 7,9, cho thấy nước qua quá trình lọc gần trung tính Nghiệm thức NT3 sử dụng than hoạt tính có giá trị pH cao hơn các nghiệm thức khác trong khoảng thời gian từ ngày 4 đến 10 Nghiệm thức NT1 (đối chứng) ghi nhận sự tăng pH đến ngày thứ 6, sau đó giảm vào ngày thứ 7 và lại tăng đến ngày thứ 10 Các nghiệm thức NT2 (cát), NT4 (cỏ Vetiver trồng trong cát) và NT5 (cỏ Năng trồng trong cát) có sự biến đổi pH tương đối giống nhau trong suốt thời gian thí nghiệm.
4.2.2 Ảnh hưởng của quá trình lọc nước sau keo tụ đến hàm lượng ammonium trong nước rỉ rác
4.2.2.1 Ảnh hưởng của quá trình lọc nước sau keo tụ của các nghiệm thức đến hàm lượng ammonium trong nước rỉ rác
Bảng 11: Ảnh hưởng của quá trình lọc nước sau keo tụ của các nghiệm thức đến hàm lượng ammonium trong nước rỉ rác
Nghiệm thức Hàm lượng ammonium (mg/L)
NT4: Cỏ Vetiver trồng trong cát
NT5: Cỏ Năng trồng trong cát
Theo bảng 11, hàm lượng ammonium trong các nghiệm thức đều giảm so với nghiệm thức NT1 [Đối chứng], với nghiệm thức NT3 [Than hoạt tính] có hàm lượng ammonium thấp nhất là 19,82 mg/L Kiểm định LSD0,01 cho thấy nghiệm thức NT2 [cát], NT4 [Cỏ Vetiver trồng trong cát] và NT5 [Cỏ Năng trồng trong cát] không có sự khác biệt có ý nghĩa thống kê, trong khi các nghiệm thức còn lại đều có sự khác biệt có ý nghĩa thống kê ở mức 1% Kết quả này cho thấy khả năng xử lý hàm lượng ammonium của cỏ Năng và Vetiver không khác biệt so với việc lọc bằng cát.
4.2.2.2 Ảnh hưởng của quá trình lọc nước sau keo tụ đến hàm lượng ammonium trong nước rỉ rác theo thời gian
Hình 17: Ảnh hưởng của quá trình lọc nước sau keo tụ đến hàm lượng ammonium trong nước rỉ rác theo thời gian
Hàm lượng ammonium trong mẫu nước đã được ghi nhận là 19,6 mg/L vào ngày thứ 1, tăng lên 42 mg/L vào ngày thứ 7 Tuy nhiên, từ ngày thứ 7 đến ngày thứ 10, hàm lượng ammonium có xu hướng giảm, kết thúc ở mức 34,9 mg/L vào ngày thứ 10.
4.2.2.3 Ảnh hưởng của quá trình lọc nước sau keo tụ của các nghiệm thức đến hàm lượng ammonium trong nước rỉ rác theo thời gian
Hà m l ượ ng a m moni u m (mg/ L) ĐC NT2 NT3 NT4 NT5
Hình 18: Ảnh hưởng của quá trình lọc nước sau keo tụ của các nghiệm thức đến hàm lượng ammonium trong nước rỉ rác theo thời gian
Ghi chú: NT1 = Đối chứng; NT2 = Cát; NT3 = Than hoạt tính; NT4 = Cỏ Vetiver trồng trong cát; NT5 = Cỏ Năng trồng trong cát
Nghiệm thức NT3 sử dụng than hoạt tính cho thấy hàm lượng ammonium thấp nhất sau 10 ngày, trong khi hàm lượng ammonium ở các nghiệm thức NT2 (cát), NT4 (cỏ Vetiver trồng trong cát) và NT5 (cỏ Năng trồng trong cát) không có sự khác biệt đáng kể Kết quả cho thấy cỏ Vetiver và cỏ Năng có khả năng xử lý hàm lượng ammonium rất thấp Đặc biệt, than hoạt tính có hiệu quả hấp thụ ammonium trong nước, với giá trị trung bình đạt 19,82 mg/L, đáp ứng tiêu chuẩn loại B1 theo QCVN 25: 2009/BTNMT của Bộ Tài nguyên và Môi trường.
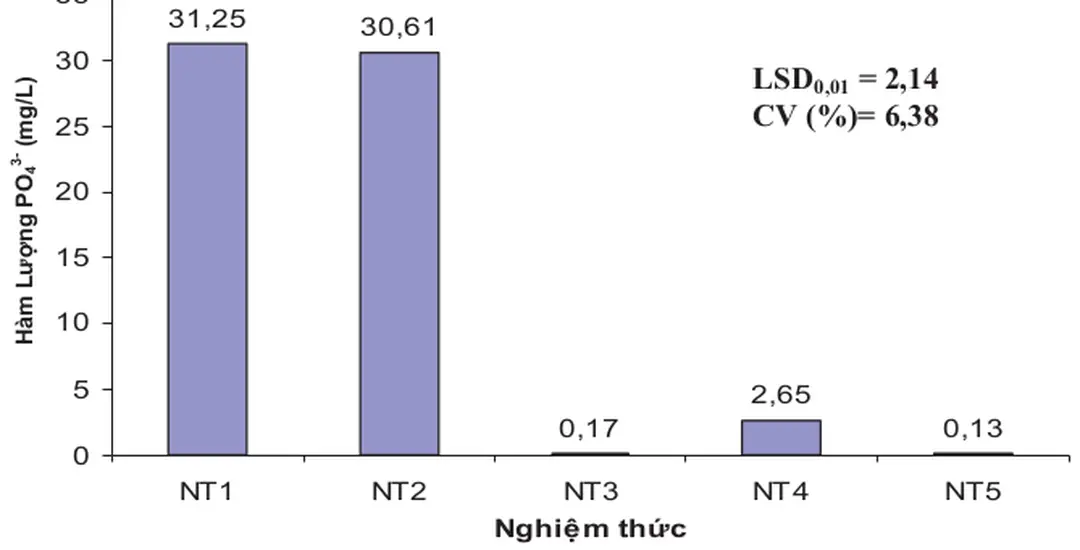
4.2.3 Ảnh hưởng của quá trình lọc nước sau keo tụ đến hàm lượng PO 4 3- trong nước rỉ rác
4.2.3.1 Ảnh hưởng của quá trình lọc nước sau keo tụ của các nghiệm thức đến hàm lượng PO 4 3- trong nước rỉ rác
Bảng 4.3: Ảnh hưởng của quá trình lọc nước sau keo tụ của các nghiệm thức đến hàm lượng PO 4 3- trong nước rỉ rác
Nghiệm thức Hàm lượng PO 4 3- (mg/L)
NT4: Cỏ Vetiver trồng trong cát
NT5: Cỏ Năng trồng trong cát
Bảng 4.3 cho thấy, sau quá trình lọc nước, hàm lượng PO4 3- ở các nghiệm thức vẫn rất thấp, dưới 0,6 mg/L Nghiệm thức NT4 [Cỏ Vetiver trồng trong cát] có hàm lượng PO4 3- thấp nhất, chỉ 0,20 mg/L Kiểm định LSD0,01 cho thấy NT4 và NT5 [Cỏ Năng trồng trong cát] không có sự khác biệt thống kê Nghiệm thức NT2 [Cát] cũng không khác biệt so với NT1 [Đối chứng], trong khi các nghiệm thức còn lại đều khác biệt có ý nghĩa thống kê ở mức 1% Kết quả cho thấy Cỏ Vetiver và Cỏ Năng trồng trong cát có khả năng xử lý hiệu quả hàm lượng PO4 3- còn lại sau quá trình keo tụ.
Than hoạt tính Nhưng nhìn chung các nghiệm thức đều có hàm lượng PO4 3- đạt tiêu chuẩn cho phép
4.2.3.2 Ảnh hưởng của quá trình lọc nước sau keo tụ đến hàm lượng PO 4 3- trong nước rỉ rác theo thời gian
Hình 19: Ảnh hưởng của quá trình lọc nước sau keo tụ đến hàm lượng ammonium trong nước rỉ rác theo thời gian
Hàm lượng PO4 3- trong nghiên cứu cho thấy sự biến động rõ rệt, với mức cao nhất đạt 0,66 mg/L vào ngày thứ 1 và thấp nhất là 0,07 mg/L vào ngày thứ 10 Từ ngày 1 đến ngày 3, hàm lượng này giảm xuống, sau đó tăng trở lại vào ngày 5 trước khi giảm xuống còn 0,15 mg/L vào ngày 6 Từ ngày 6, hàm lượng PO4 3- lại tăng lên vào các ngày 7, 8 và 9, rồi giảm xuống mức 0,07 mg/L vào ngày 10 Kết quả cho thấy hàm lượng PO4 3- dao động trong khoảng từ 0,07 mg/L đến 0,66 mg/L.
4.2.3.3 Ảnh hưởng của quá trình lọc nước sau keo tụ của các nghiệm thức đến hàm lượng PO 4 3- trong nước rỉ rác theo thời gian
NT1 NT2 NT3 NT4 NT5
Hình 20: Ảnh hưởng của quá trình lọc nước sau keo tụ của các nghiệm thức đến hàm lượng PO 4 3- trong nước rỉ rác theo thời gian
Ghi chú: NT1 = Đối chứng; NT2 = Cát; NT3 = Than hoạt tính; NT4 = Cỏ Vetiver trồng trong cát; NT5 = Cỏ Năng trồng trong cát
Hình 20 cho thấy nghiệm thức NT4 (Cỏ Vetiver trồng trong cát) và NT5 (Cỏ Năng trồng trong cát) có hàm lượng PO4 3- thấp trong suốt thời gian theo dõi Đặc biệt, vào ngày 6 và 10, hàm lượng PO4 3- đạt mức thấp nhất ở các nghiệm thức này Ngược lại, nghiệm thức NT1 (Đối chứng) và NT2 (Cát) ghi nhận hàm lượng PO4 3- cao hơn so với các nghiệm thức khác trong toàn bộ thời gian Giá trị CV (%) cũng được ghi nhận trong nghiên cứu.
Biểu đồ cho thấy sự biến động hàm lượng PO4³⁻ theo thời gian, với kết quả thí nghiệm 22,8 cho thấy nguồn nước sau keo tụ có hàm lượng PO4³⁻ rất thấp Trong thí nghiệm 2, quá trình lọc đã làm thay đổi hàm lượng PO4³⁻, một phần do giá trị thấp dễ dẫn đến sai số khi đo Tuy nhiên, nhìn chung, các nghiệm thức đều đạt tiêu chuẩn cho phép với hàm lượng PO4³⁻ dưới 1 mg/L.
4.2.4 Ảnh hưởng của quá trình lọc nước sau keo tụ đến hàm lượng COD trong nước rỉ rác
NT1 NT2 NT3 NT4 NT5
Hình 21: Ảnh hưởng của quá trình lọc nước sau keo tụ của các nghiệm thức đến hàm lượng COD trong nước rỉ rác ở ngày thứ 10
Ghi chú: NT1 = Đối chứng; NT2 = Cát; NT3 = Than hoạt tính; NT4 = Cỏ Vetiver trồng trong cát; NT5 = Cỏ Năng trồng trong cát
Kết quả thí nghiệm cho thấy hàm lượng COD cao nhất đạt 374 mg/L ở nghiệm thức NT1 [Đối chứng], trong khi nghiệm thức NT3 [Than hoạt tính] ghi nhận hàm lượng thấp nhất là 346,5 mg/L Kiểm định LSD0,01 chỉ ra rằng không có sự khác biệt có ý nghĩa thống kê giữa nghiệm thức NT2 [Cát] với NT1 [Đối chứng] và NT2 [Cát] với NT4 [Cỏ Vetiver trồng trong cát], trong khi các nghiệm thức còn lại đều khác biệt có ý nghĩa thống kê ở mức 1% Kết quả cho thấy than hoạt tính có khả năng hấp thụ các chất hóa học trong nước tốt hơn so với các nghiệm thức khác, với hàm lượng COD 346,5 mg/L đạt tiêu chuẩn B1 của QCVN 25:2009/BTNMT về nước thải bãi chôn lấp chất thải rắn.
4.2.4 Ảnh hưởng của quá trình lọc nước sau keo tụ đến hàm lượng tổng chất rắn lơ lửng (TSS) trong nước rỉ rác
NT1 NT2 NT3 NT4 NT5
Hình 22: Ảnh hưởng của quá trình lọc nước sau keo tụ của các nghiệm thức đến hàm lượng TSS trong nước rỉ rác ở ngày thứ 10
Ghi chú: NT1 = Đối chứng; NT2 = Cát; NT3 = Than hoạt tính; NT4 = Cỏ Vetiver trồng trong cát; NT5 = Cỏ Năng trồng trong cát
Kết quả phân tích cho thấy hàm lượng TSS cao nhất đạt 159,5 mg/L ở nghiệm thức NT1 [Đối chứng], trong khi nghiệm thức NT2 [Cát] có hàm lượng TSS thấp nhất là 58,3 mg/L Kiểm định LSD0,01 cho thấy sự khác biệt thống kê ở mức ý nghĩa 1% giữa các nghiệm thức Điều này chứng tỏ cát có khả năng giữ lại các chất rắn lơ lửng trong nước tốt, nhờ vào kích thước nhỏ của các hạt cát tạo ra khe hở giúp lọc hiệu quả Sau quá trình lọc nước tại nghiệm thức NT2, hàm lượng TSS đạt 58,3 mg/L, đáp ứng tiêu chuẩn loại B theo QCVN 24:2009/BTNMT về nước thải công nghiệp.
4.2.5 Ảnh hưởng của quá trình lọc nước sau keo tụ đến hàm lượng phospho tổng (TP) trong nước rỉ rác
NT1 NT2 NT3 NT4 NT5
Nghiệm thức hà m l ượ n g TP ( m g/ L)
Hình 23: Ảnh hưởng của quá trình lọc nước sau keo tụ của các nghiệm thức đến hàm lượng TP trong nước rỉ rác ở ngày thứ 10
Ghi chú: NT1 = Đối chứng; NT2 = Cát; NT3 = Than hoạt tính; NT4 = Cỏ Vetiver trồng trong cát; NT5 = Cỏ Năng trồng trong cát
Hàm lượng phospho tổng trong các nghiệm thức được nghiên cứu cho thấy nghiệm thức NT3 [Than hoạt tính] có mức cao nhất là 7,80 mg/L, trong khi nghiệm thức NT4 [Cỏ Vetiver trồng trong cát] ghi nhận mức thấp nhất là 1,03 mg/L Kiểm định LSD0,01 cho thấy các nghiệm thức NT2 [cát], NT3 [Cỏ Vetiver trồng trong cát] và NT5 [Cỏ Năng trồng trong cát] không có sự khác biệt thống kê, trong khi các nghiệm thức còn lại đều có sự khác biệt thống kê ở mức ý nghĩa 1%.
Kết quả phân tích cho thấy than hoạt tính có khả năng tăng hàm lượng TP trong nước sau quá trình lọc Các nghiệm thức sử dụng cát và cỏ Vetiver cho thấy hiệu quả cao trong việc xử lý TP, với hàm lượng TP đạt từ 1,03 mg/L đến 1,22 mg/L, đáp ứng tiêu chuẩn loại A theo QCVN 24: 2009/BTNMT về nước thải công nghiệp.
4.2.5 Ảnh hưởng của quá trình lọc nước sau keo tụ đến hàm lượng nitơ tổng (TKN) trong nước rỉ rác
NT1 NT2 NT3 NT4 NT5
Hình 24: Ảnh hưởng của quá trình lọc nước sau keo tụ của các nghiệm thức đến hàm lượng TKN trong nước rỉ rác ở ngày thứ 10
Ghi chú: NT1 = Đối chứng; NT2 = Cát; NT3 = Than hoạt tính; NT4 = Cỏ Vetiver trồng trong cát; NT5 = Cỏ Năng trồng trong cát
Kết luận
Vi khuẩn Enterobacter aerogenes dòng P11 kết hợp với PAC cho hiệu quả xử lý nước rỉ rác tốt, thân thiện với môi trường và tiết kiệm chi phí Kết quả thí nghiệm cho thấy nước sau keo tụ ở nghiệm thức NT3 sử dụng than hoạt tính đạt tiêu chuẩn loại B của QCVN 25: 2009/BTNMT, với khả năng xử lý hàm lượng ammonium, COD và TKN hiệu quả Trong khi đó, nghiệm thức NT2 sử dụng cát cho thấy khả năng xử lý tốt hàm lượng TSS và TP trong nước rỉ rác.
Đề nghị
Nghiên cứu này nhằm xác định tỷ lệ tối ưu giữa hóa chất PAC và vi khuẩn Enterobacter aerogenes dòng P11, cũng như pH thích hợp để keo tụ nước rỉ rác sau khi xử lý bằng vi khuẩn khử đạm và lân, nhằm đạt hiệu quả keo tụ tốt nhất.
Nghiên cứu để tìm ra nhiều phương pháp lọc khác nhau thích hợp cho hiệu quả lọc nước sau keo tụ tốt hơn nữa
Hoàn thiện quy trình xử lý nước rỉ rác và thải ra môi trường.










![Hình 25: Kết hợp nghiệm thức NT3 [Than hoạt tính] và NT2 [Cát] để lọc nước sau keo tụ xử lý - ỨNG DỤNG VI KHUẨN kết tụ kết hợp hóa CHẤT PAC + POLYMER và CÁNH ĐỒNG lọc xử lý nước rỉ rác](https://media.store123doc.com/figures/001/930/hinh-ket-hop-nghiem-thuc-than-hoat-nuoc-1930806.png)


