GIỚI THIỆU CHUNG
Giới thiệu về pectin
Pectin là một polysaccharide rất phức tạp được tạo thành từ ba vùng chính là Homogalacturonan,
Rhamnogalacturonan I và Rhamnogacacturonan II được liên kết với nhau bằng liên kết cộng hóa trị Vùng chính của pectin bao gồm một chuỗi các đơn vị acid D-Galacturonic liên kết với nhau bằng liên kết ∝-1,4- glycosidic được gọi là vùng Homogalacturonan hoặc vùng pectin trơn Vùng thứ hai của cấu trúc pectin bao gồm các đơn vị Rhamnosyl liên kết với nhau bằng liên kết ∝-1,4-glycosidic Các đơn vị D-
Galacturonopyransyl có thể bị gián đoạn bởi các đơn vị L-Rhamnopyranosyl thông qua liên kết ∝-1,4-glycosidic, tạo thành Rhamnogalacturonan I kết hợp với Arabinose và Galactose Rhamnogalacturonan II, mặc dù chỉ là một phần tử nhỏ, nhưng lại bao gồm Oligosaccharide Homogalacturonan phân nhánh cao, đóng vai trò quan trọng trong cấu trúc của pectin.
Phân tử lượng của pectin từ các nguồn quả khác nhau dao động trong khoảng 10,000 - 100,000, phụ thuộc vào số lượng phân tử acid galacturonic Pectin có chiều dài phân tử lớn hơn tinh bột nhưng nhỏ hơn cellulose Chẳng hạn, pectin từ táo và mận có phân tử lượng từ 25,000 đến 35,000, trong khi pectin từ cam có thể đạt tới 50,000 Khối lượng phân tử của pectin thương phẩm không cố định mà thay đổi theo nguồn nguyên liệu, phương pháp trích ly và loại sản phẩm.
Pectin là một hợp chất tự nhiên phong phú trong màng tế bào của thực vật bậc cao, chủ yếu tập trung ở các bộ phận như quả, củ và thân Trong cấu trúc màng tế bào, pectin xuất hiện nhiều nhất ở phiến giữa và vách tế bào sơ cấp.
Pectin là một polysaccharide quan trọng có mặt trong quả, củ và thân cây, đóng vai trò thiết yếu trong việc vận chuyển nước và các chất dinh dưỡng cho trái cây đang trưởng thành, đồng thời duy trì hình dáng và độ cứng của chúng Trong cấu trúc tế bào thực vật, pectin thường kết hợp với cellulose và hemicellulose, tạo thành một bức tường bảo vệ vững chắc cho tế bào Nhờ khả năng kết dính mạnh mẽ, pectin được ví như chất xi măng, giữ cho các tế bào thực vật gắn kết chặt chẽ với nhau.
Protopectin, tiền thân của pectin, không tan trong nước và chủ yếu có trong mô trái cây xanh, giúp quả giữ được độ cứng Trong quá trình bảo quản, lượng protopectin giảm dần trong khi pectin hòa tan tăng lên Khi quả chín, protopectin bị thủy phân thành pectin hòa tan, làm giảm liên kết giữa các tế bào và khiến quả mềm hơn Sự demethyl hóa do enzyme protopectinase và quá trình depolymer hóa của pectin tạo thành pectate, dẫn đến sự hình thành các loại đường hòa tan và acid Quá trình này cũng diễn ra dưới tác động của acid và nhiệt độ trong quá trình chần ở nhiệt độ từ 60 đến 85 độ C.
Pectin là một polysaccharide quan trọng trong cấu trúc thành tế bào thực vật, tồn tại với hàm lượng khác nhau ở các loại quả, củ và thân cây Ví dụ, hàm lượng pectin trong táo dao động từ 10 - 15%, trong chanh từ 20 - 50%, củ cải đường từ 10 - 20%, và đài hoa hướng dương từ 15 - 25% Các nguồn pectin khác nhau sẽ có khả năng tạo gel khác nhau và thành phần nhóm methoxyl trong phân tử cũng có sự khác biệt Đặc biệt, trong cùng một loại quả, hàm lượng pectin có thể thay đổi theo từng phần; chẳng hạn, trong quả bưởi, pectin chủ yếu là chất nhầy bao quanh vỏ hạt và trong cùi quả bưởi chín, với hàm lượng pectin khác nhau giữa các phần của quả.
Bảng 1 Phần trăm pectin trong các phần của quả bưởi
Thành phần Khối lượng (%) Hàm lượng pectin (%) Hiệu suất thu hồi
Pectin là một polysaccharide tự nhiên được chiết xuất từ các nguyên liệu thực vật và phụ phẩm nông nghiệp như bã táo, vỏ bưởi, cam và chanh Tỷ lệ pectin trong các loại vỏ cam quýt dao động từ 20 – 50% trọng lượng khô, trong khi bã táo chứa từ 10 – 20% pectin Pectin có khả năng tan trong nước và sở hữu độ nhớt cao, mà độ nhớt này phụ thuộc vào kích thước phân tử, mức độ methyl hóa, pH, lượng đường và hàm lượng một số ion có mặt.
Phân loại pectin
Dựa trên mức độ methoxyl hóa và ester hóa, trong thương mại chia pectin thành 2 loại: pectin có độ methoxyl hóa cao và pectin có độ methoxyl hóa thấp
Pectin methoxyl hóa cao (HMP) có chỉ số DE lớn hơn 50% hoặc MI trên 7%, giúp tăng độ nhớt cho sản phẩm Để tạo đông, cần đảm bảo pH trong khoảng 3.1 – 3.4 và nồng độ đường phải trên 60%.
Hình 3 Công thức của HMP
Pectin methoxyl hóa thấp (Low Methoxyl Pectin - LMP) có chỉ số DE dưới 50% hoặc MI dưới 7%, được sản xuất bằng cách giảm nhóm methoxyl trong cấu trúc phân tử Loại pectin này có khả năng tạo đông trong môi trường không có đường, và thường được sử dụng để làm màng bao bọc cho các sản phẩm.
Hình 4 Công thức của LMP Dựa trên khả năng hòa tan trong nước chia pectin thành 2 loại: pectin hòa tan và pectin không hòa tan
Pectin hòa tan, hay còn gọi là methoxyl polygalacturonic, chủ yếu tồn tại trong dịch tế bào và là ester methylic của acid polygalacturonic Trong tự nhiên, khoảng 2/3 số nhóm carboxyl của acid polygalacturonic được ester hóa bằng methanol Pectin có mức độ ester hóa cao sẽ tạo ra gel đặc trong dung dịch acid và dung dịch đường có nồng độ 65% Enzyme pectinase tác động lên các hợp chất pectin với khối lượng phân tử khác nhau và cấu trúc hóa học không đồng nhất.
Pectin không hòa tan, hay protopectin, là dạng kết tủa của pectin kết hợp với araban, một polysaccharide có trong thành tế bào Chất này tạo độ cứng cho quả xanh và không tan trong nước do có cấu trúc phức tạp Khi protopectin bị thủy phân bằng acid, nó sẽ giải phóng pectin hòa tan.
Thành phần các pectin trong thực phẩm
Pectin là thành phần chính của tế bào thực vật, chiếm khoảng hai phần ba khối lượng khô của thành tế bào, giúp định hình cấu trúc và đảm bảo tính bền vững, linh hoạt cho tế bào Nó hoạt động như một rào cản bảo vệ môi trường bên ngoài và là nguồn cung cấp chất xơ quan trọng Mặc dù con người không thể tiêu hóa pectin trực tiếp do thiếu enzyme, nhưng vi sinh vật trong ruột già có khả năng chuyển hóa pectin thành chất xơ hòa tan, thúc đẩy hệ vi sinh vật có lợi và hỗ trợ chuyển hóa lipid, điều hòa đường huyết Ngoài các chức năng sinh học, pectin còn có tiềm năng lớn trong nhiều ứng dụng khác, từ chế biến thực phẩm đến dược phẩm.
Pectin công nghiệp chủ yếu được chiết xuất từ cam chanh và táo, với hàm lượng pectin trong táo khoảng 10 - 15% và trong vỏ chanh lên đến 20 - 30% Ngoài ra, pectin còn được chiết xuất từ các loại trái cây khác như vỏ xoài, vỏ thanh long, vỏ chuối và vỏ chanh dây Mặc dù một số loại trái cây cung cấp hàm lượng pectin cao hơn, chất lượng pectin không nhất thiết phải tốt hơn, do cấu trúc và loại đường liên kết khác nhau giữa các loại trái cây dẫn đến các loại gel pectin khác nhau.
Bảng 2 Chiết xuất pectin trong công nghiệp
Bộ phận sử dụng Phương pháp tách chiết Hàm lượng pectin Loại pectin
Thanh long Vỏ Được chiết bằng HCl, kết tủa và tinh chế với isopropanol 70% và 99.6%
Mít Vỏ Pectin chiết xuất được hỗ trợ bằng sóng siêu âm 21.5% HMP
Khoai tây Thịt quả Chiết xuất bằng các acid khác nhau và kết tủa bằng ethanol
Tính chất hóa lý và hóa học của pectin
Pectin khi hòa tan trong nước tạo ra dung dịch có độ nhớt cao Khi tiếp xúc với nước, pectin hấp thụ nước và trương nở nhiều lần so với kích thước ban đầu Nếu các hạt pectin dính vào nhau trước khi tiếp xúc với nước, chúng sẽ trương lên và kết lại thành viên lớn, gây khó khăn trong việc hòa tan Ngược lại, nếu các hạt pectin được tách rời, chúng có đủ không gian để trương nở mà không dính vào nhau Do đó, để tránh hiện tượng vón cục, cần tách rời các hạt pectin trước khi cho chúng tiếp xúc với nước.
* Các yếu tố ảnh hưởng đến khả năng hòa tan của pectin:
- Nhiệt độ hòa tan: Nhiệt độ càng cao thì pectin hòa tan càng tốt, nhiệt độ thích hợp nhất để hòa tan pectin là trên 80 o C
- Thời gian hòa tan càng lâu, pectin càng tan được nhiều hơn
- Tốc độ khuấy càng cao, pectin hòa tan càng tốt
Để đảm bảo pectin hòa tan hiệu quả, nồng độ chất khô trong dịch nấu khi bổ sung pectin không nên vượt quá 25% Nồng độ chất khô lý tưởng nhất là dưới 20%.
1.4.1.2 Độ nhớt của dung dịch pectin Độ nhớt càng lớn, khối lượng phân tử và khả năng tạo đặc của pectin sẽ càng lớn
So với các gum thực vật và các chất tạo đặc khác, dung dịch pectin có độ nhớt tương đối thấp Độ nhớt của pectin còn phụ thuộc vào:
Ion Ca2+ và các ion đa hóa trị khác có tác dụng làm tăng độ nhớt của dung dịch pectin Vì vậy, độ nhớt của dung dịch pectin sẽ bị ảnh hưởng bởi độ cứng của nước.
- pH cũng ảnh hưởng đến độ nhớt của dung dịch pectin, trong dung dịch không chứa Ca 2+ , độ nhớt của dung dịch pectin sẽ giảm khi pH > 3.5.
1.4.1.3 Khả năng tạo nhũ và ổn định nhũ tương
Pectin chứa các nhóm ưa nước như carboxyl và hydroxyl, cùng với nhóm kỵ nước methoxyl, giúp hấp phụ lên bề mặt phân pha Điều này tạo ra một lớp màng đặc bao quanh các giọt phân tán, ngăn cản hiện tượng tụ giọt hiệu quả.
Pectin được sử dụng rộng rãi như một chất ổn định nhũ tương trong các sản phẩm thực phẩm như sốt mayonnaise và nước sốt cho rau trộn Khi hòa tan trong pha liên tục, pectin tăng độ nhớt của hệ phân tán, giúp hạn chế chuyển động của các giọt phân tán và giảm va chạm giữa chúng, từ đó ngăn chặn sự tụ giọt Khả năng tạo đặc và ổn định hệ nhũ tương là hai tính chất quan trọng mà pectin mang lại.
Pectin là một thành phần quan trọng trong việc tạo gel cho thực phẩm, đóng vai trò thiết yếu trong việc ổn định nhiều pha Khả năng tạo gel của pectin giúp cải thiện cấu trúc và độ ổn định cho các sản phẩm thực phẩm.
Pectin có tác dụng tạo gel chủ yếu trong sản phẩm mứt trái cây, mang lại hương vị thơm ngon và giúp duy trì cấu trúc Trong một số trường hợp, pectin còn được kết hợp với carrageenan để nâng cao hiệu quả tạo gel Đặc tính quan trọng của pectin là khả năng tạo gel khi có mặt của acid và đường, điều này được ứng dụng rộng rãi trong công nghệ sản xuất bánh kẹo.
1.4.2.1 Phản ứng de-ester hóa
Phản ứng de-ester hóa diễn ra tại đầu ester của các phân tử acid D-galacturonic trong chuỗi polysaccharide dài của pectin Quá trình này thay thế gốc -OCH3 bằng -OH thông qua acid hoặc base, dẫn đến việc giảm mức độ ester hóa của phân tử pectin.
Hình 5 Phản ứng de-ester hóa giữa pectin và dung dịch NaOH 1.4.2.2 Phản ứng tạo kết tủa với ion kim loại
Phản ứng tạo kết tủa diễn ra ở đầu ester của các phân tử acid D-galacturonic trong chuỗi polysaccharide dài của pectin Quá trình này liên quan đến việc thay thế gốc -OCH3 bằng -OM, trong đó M đại diện cho các ion kim loại như Ca 2+ và Cu 2+.
Fe 3+ , Mg 2+ …), phản ứng này tạo ra kết tủa
Hình 6 Kết tủa Calcium pectate 1.4.2.3 Phản ứng amide hóa
The amidation reaction occurs at the ester end of D-galacturonic acid molecules within the linear polysaccharide chain of pectin The resulting products are influenced by the nature of the amine used, whether it is a primary amine or a secondary amine.
Hình 7 Phản ứng amide hóa giữa pectin và amine bậc 1 1.4.2.4 Phản ứng với enzyme pectinase
Tùy thuộc vào bản chất mà enzyme sẽ khác nhau về cách cắt đứt liên kết giữa các phân tử Có 3 loại enzyme điển hình thuộc nhóm enzyme pectinase:
- Protopectinases: phân hủy protopectin không hòa tan và tạo ra pectin có khả năng hòa tan có mức độ polymer hóa cao
- Esterase: thủy phân ester methoxyl của pectin thành acid và rượu khi có mặt nước
- Depolymerase: xúc tác sự phân cắt thủy phân của liên kết 1,4-glycosidic của các phân tử acid D- galacturonic
Hình 8 Phản ứng của enzyme pectinase
1.4.2.5 Phản ứng thủy phân cắt mạch với acid
Pectin là một loại carbohydrate, và dưới điều kiện axit mạnh cùng với nhiệt độ cao và sự khuấy trộn, pectin sẽ bị phá hủy liên kết 1,4-glycosidic của D-galacturonic acid, tương tự như cách mà enzyme tương tác.
Lưu ý chung
Pectin là một trong những chất phụ gia thực phẩm an toàn và được chấp nhận rộng rãi, với hàm lượng ADI cho phép được xác định là “không xác định” bởi các tổ chức uy tín như JECFA, SCF tại Liên minh Châu Âu và GRAS.
Các chỉ số đặc trưng của pectin:
Chỉ số Methoxyl (MI 1 hay DM 2) là thước đo tỷ lệ methyl hóa của pectin, được xác định bằng phần trăm khối lượng nhóm methoxyl (-OCH3) so với tổng khối lượng phân tử.
▪ Pectin tách từ thực vật 10 - 12%
Chỉ số Ester hóa (DE 3) thể hiện mức độ ester hóa, được tính bằng tỷ lệ phần trăm của các gốc acid galacturonic đã ester hóa so với tổng số gốc acid galacturonic trong phân tử.
Chỉ số Amide hóa (DA 4) là thước đo mức độ amide hóa của pectin, thể hiện tỷ lệ phần trăm nhóm carboxyl đã được chuyển hóa thành nhóm amide thông qua quá trình xử lý bằng amoniac so với tổng số nhóm carboxyl có trong phân tử pectin.
CÁC PHƯƠNG PHÁP PHÂN TÍCH
Các phương pháp xác định hàm lượng pectin trong mẫu thực phẩm
Trong môi trường kiềm loãng, pectin hòa tan giải phóng nhóm methoxyl thành rượu methylic và acid pectic tự do Acid pectic tự do kết hợp với acid acetic tạo thành muối kết tủa calcium pectate khi có mặt CaCl2 Hàm lượng muối kết tủa này cho phép xác định hàm lượng pectin có trong mẫu phân tích.
Phương pháp Calcium pectate là một trong những kỹ thuật phổ biến nhất hiện nay để xác định hàm lượng pectin trong thực phẩm, đặc biệt là trong lĩnh vực thực vật và trái cây, thông qua quá trình kết tủa Calcium.
✓ Nguyên liệu: Mẫu pectin đã được trích ly từ thực phẩm cần phân tích hàm lượng pectin
Dung dịch CaCl2 2N Dung dịch NaOH 0,1N
Cân phân tích Beaker 1000mL
Giấy lọc Bình định mức 1000mL
Dung dịch CaCl2 2N: Hòa tan 230 – 250g CaCl2 trong bình dung tích 1000mL, sau đó định mức
1000mL bằng nước cất Dung tích phải có tỷ trọng 1,09 g/cm 3 không cần xác định nồng độ chuẩn
Dung dịch NaOH 0,1N: Hòa tan 4g NaOH trong bình định mức có dung tích 1000mL, sau đó định mức 1000mL bằng nước cất
Dung dịch CH3COOH 1N: pha loãng 60,03 mL acid acetic đậm đặc bằng nước cất đến 1000mL
Để phân tích mẫu pectin, đầu tiên cần cân khoảng 15g pectin đã được trích ly và cho vào bình Tiếp theo, thêm 100ml dung dịch NaOH 0,1N vào bình và để hỗn hợp này trong khoảng 7 giờ hoặc qua đêm nhằm đảm bảo quá trình xà phòng hóa hoàn toàn pectin thành acid pectic.
Bước 2: Lọc hỗn hợp qua giấy lọc và thêm 50mL dung dịch CH3COOH 1N vào dịch lọc
Bước 3: Sau 5 phút, thêm 50mL CaCl2 2N và giữ 1 giờ
Bước 4: Đun sôi hỗn hợp trong 5 phút rồi lọc qua giấy lọc đã được sấy đến khối lượng không đổi (m1)
Bước 5: Rửa kết tủa Calcium pectate bằng nước cất nóng cho đến khi không còn ion Cl- Để kiểm tra, sử dụng dung dịch AgCl 1% cho đến khi không xuất hiện kết tủa trắng.
Bước 6: Sau khi rửa xong, đặt giấy lọc có kết tủa vào chén cân và sấy ở 105 o C đến khối lượng không đổi
Hàm lượng pectin (P) tính theo công thức sau:
Trong đó: P (%) - hàm lượng pectin có trong mẫu m 2 (g) - khối lượng giấy lọc có kết tủa m 1 (g) - khối lượng giấy lọc không có kết tủa
(191×2)+40≈ 0,92 - hệ số chuyển đổi từ Calcium pectate về pectin m (g) - khối lượng mẫu phân tích
2.2.2 Phương pháp đo quang phổ thông qua ion Cu 2+
Trong việc xác định hàm lượng pectin bằng phương pháp Calcium pectate, ion Ca 2+ được sử dụng làm chất kết tủa, nhưng việc đo độ hấp thụ của Ca 2+ gặp khó khăn trừ khi có thêm tác nhân tạo màu Ngay cả khi có tác nhân tạo màu, độ hấp thụ chỉ có thể được đo trong môi trường tối và thường có sự biến động lớn Do đó, ion Cu 2+ được lựa chọn để đo lường, vì nó có khả năng phản ứng với dung dịch đệm để tạo ra đồng Cu2(OH)2CO3 Phương pháp này có những điểm tương đồng với phương pháp định lượng đường khử bằng phương pháp DNS trong các mẫu thực phẩm.
Hình 11 Độ hấp thu của Cu 2+ trong dung dịch đệm
Công thức phân tử của đồng pectate là C17H22O16Cu, với đồng (Cu) chiếm 11,72% khối lượng Hàm lượng đồng pectate có thể được xác định thông qua việc đo hàm lượng Cu 2+ trong dịch lọc.
Hình 12 Phương trình phản ứng của Pectin và Cu 2+
Phương pháp đo quang phổ qua ion Cu 2+ là một kỹ thuật mới để xác định hàm lượng pectin trong thực phẩm một cách gián tiếp Phương pháp này có phạm vi ứng dụng tương tự như phương pháp Calcium pectate.
Quy trình thí nghiệm tại Trung Quốc sử dụng các hóa chất và thuốc thử từ các công ty thương mại trong nước.
- Quang phổ kế FT-IR FTIR: Nicolet IS50
- Máy Electron - Thermostatic Water Bath HH - 6
- Máy quang phổ UV-Vis: UV-1900, Shimadzu, Japan
✓ Thiết lập đường cong làm việc của Cu 2+
Bước 1: Lấy 2mL dung dịch CuCl2 ở các nồng độ khác nhau từ 3 tới 10.5 mmol/L cho vào bình định mức
10mL có chứa dung dịch đệm tương ứng sau đó chuyển vào cuvette thạch anh và sử dụng dung dịch đệm làm mẫu trắng
Bước 2: Xác định độ hấp thụ của hỗn hợp ở bước sóng 712 nm bằng máy quang phổ UV-Vis
Bước 3: Dựng một đường chuẩn tuyến tính được thiết lập giữa độ hấp thụ và hàm lượng của Cu 2+ Ta sẽ đo trong một số điều kiện như sau:
- Thực hiện ở nhiệt độ phòng
- Bước sóng xác định ở 712 nm
- Thời gian phản ứng: hơn 30s do cần tối thiểu 30s để ion Cu 2+ chuyển hóa hoàn toàn thành
Cu2(OH)2CO3. Đường cong làm việc của mối quan hệ giữa nồng độ Cu 2+ và độ hấp thụ ở bước sóng 712nm được biểu diễn như sau:
Trong đó: C là nồng độ của Cu 2+ trong hệ (mol/L)
A là độ hấp thụ của dung dịch ở bước sóng 712 nm
Hình 13 Đường chuẩn giữa nồng độ Cu 2+ và độ hấp thụ ở bước sóng 712 nm
✓ Xác định hàm lượng Pectin
Lấy 2mL dịch lọc mẫu thử chứa pectin, thêm vào 10mL bình định mức với 8mL dung dịch đệm Sau khi trộn đều, chuyển hỗn hợp sang cuvette thạch anh và đo độ hấp thụ ở bước sóng 712 nm bằng máy quang phổ UV-vis để xác định hàm lượng Cu 2+ trong dịch lọc, từ đó tính toán hàm lượng pectin.
Công thức tính hàm lượng pectin như sau:
Trong đó: X là hàm lượng pectin (%)
C là nồng độ Cu 2+ theo đường cong làm việc (mmol/L) n 0 là hàm lượng Cu 2+ trước phản ứng (mmol)
V là tổng thể tích của dịch lọc (mL)
64 là khối lượng nguyên tử của đồng 0.1172 là tỷ lệ số nguyên tử đồng trong pectate đồng m 0 là khối lượng của mẫu (g)
W là độ ẩm của mẫu (%)
2.2.3 Phương pháp so màu Carbazole
Phương pháp Carbazole, được đề xuất lần đầu bởi Dische vào năm 1946, là một kỹ thuật phân tích quang phổ pectin Quy trình này bao gồm việc chiết xuất pectin từ thịt quả và rau củ, sau đó depolymer pectin bằng acid sulfuric, và cuối cùng là phản ứng tạo màu với carbazole để đo quang phổ.
Carbazole là một hydrocarbon thơm đa vòng với cấu trúc gồm hai vòng benzen và một vòng chứa nitơ Nó thường được sử dụng làm cầu liên hợp π trong sản xuất thuốc nhuộm hữu cơ Phản ứng tạo màu xảy ra khi các sản phẩm phân hủy của quá trình thủy phân pectin bằng acid đậm đặc tương tác với carbazole, và màu sắc thu được tỷ lệ thuận với nồng độ galacturonic acid.
Phương pháp so màu Carbazole là kỹ thuật phổ biến để xác định hàm lượng pectin trong trái cây và rau củ như đào, cà rốt, cam, chanh và cà chua Gần đây, phản ứng tạo màu của carbazole cũng được áp dụng để xác định hàm lượng axit galacturonic trong các polysaccharides từ phế phẩm nông nghiệp như vỏ bưởi và vỏ thanh long.
Thuốc thử Carbazole 0.1% Sulfuric acid đậm đặc
Erlen 100mL Bể điều nhiệt Tủ sấy
Beaker 100mL Phễu lọc Máy quang phổ chùm tia đôi 525nm Ống nghiệm Muỗng inox Cuvette 1mL
Pipette Bình định mức 100 mL Cân phân tích
Hòa tan 0.1g carbazole bằng ethanol trong bình định mức đến vạch 100ml, lắc đều cho đến khi tan hoàn toàn
Bước 1: Cân mẫu pectin bằng cân phân tích
Bước 2: Kết tủa mẫu pectin với lần lượt ethanol 95% và 63% Sau đó, sấy khô kết tủa và pha loãng mẫu bằng nước cất đến nồng độ 0.025%
Bước 3: Cho 0.5mL thuốc thử carbazole 0.1% và 5 - 6mL sulfuric acid đậm đặc vào ống nghiệm nhanh chóng trong 6s và lắc đều
Bước 4: Đun nóng ống nghiệm đến 85 - 100℃ trong 5 - 10 phút
Bước 5: Làm nguội ống nghiệm trong bể đá trong 5 phút
Bước 6: Sử dụng syringe để cho từng mẫu vào lọ đựng và tiến hành đo quang phổ Độ hấp thụ được xác định bằng máy quang phổ chùm tia đôi tại bước sóng 525nm, sử dụng cuvette có kích thước 1 cm.
Bước 7: Phép đo được thực hiện song song đối với mẫu trắng bao gồm 1ml nước cất, 0.5mL thuốc thử carbazole 0.1% và 5 - 6mL sulfuric acid đậm đặc
Lặp lại tương tự trong 3 lần
2.2.3.6 Tính toán kết quả Định lượng pectin trong mẫu cần xác định bằng phương trình Lambert-Beer:
Trong đó: A: Độ hấp thụ ε: Độ hấp thụ mol (LM -1 cm -1 ) b: Chiều dày cuvette (cm)
Cx: Nồng độ mẫu (mol/L) Khi dung dịch cần xác định và dung dịch chuẩn có cùng chiều dày cuvette, ta có công thức:
✓ Khối lượng acid D-Galacturonic trong mẫu được tính theo công thức như sau:
✓ Hàm lượng acid D-Galacturonic trong mẫu được tính theo công thức sau:
Trong thế kỷ XIX, các nhà khoa học đã cho rằng tổng hàm lượng D-Galacturonic acid trong thực phẩm tương đương với hàm lượng pectin Tuy nhiên, nghiên cứu hiện tại cho thấy D-Galacturonic acid chỉ chiếm tối thiểu 80% trong thực phẩm, không đạt 100% và phụ thuộc vào loại thực phẩm Do đó, công thức trước đây cần được điều chỉnh bằng cách bổ sung một hệ số thực nghiệm θ (θ ≥ 80%) để tính chính xác hàm lượng pectin trong mẫu trái cây hoặc thực phẩm.
%D − Galacturonic acid =macid D−Galacturonic m mẫu × 100%
Aacid D−Galacturonic × ε X × C tc × V x × M) × 100% m mẫu macid D−Galacturonic= m pectin × θ
BÀN LUẬN VÀ KẾT LUẬN
Bàn luận chung
3.1.1 Năng lực của phương pháp Calcium pectate
Trong ngành công nghệ thực phẩm, phương pháp Calciumum pectate được ưa chuộng để xác định hàm lượng pectin nhờ vào độ chính xác và tính lặp lại cao, cùng với chi phí thấp và khả năng hạn chế ô nhiễm môi trường Dưới đây là một số ứng dụng của phương pháp này trong các loại thực phẩm khác nhau, như được trình bày trong Bảng 3.
Bảng 3 Hàm lượng pectin trong sương sáo Việt Nam Sương sáo tươi Tiền Giang Sương sáo khô Tiền Giang Sương sáo khô Đồng Tháp
Bảng 4 Hàm lượng pectin của các thành phần khác nhau bên trong mít ở Ấn Độ
Các loại mít trong thị trường Ấn Độ
Thành phần khác nhau bên trong mít
Vỏ Lõi trắng Múi thịt
Hệ số biến thiên hàm lượng pectin trong các sản phẩm thực phẩm rất thấp, dao động từ 0.10% đến 0.16%, cho thấy độ chính xác và độ lặp lại cao của phương pháp Phương pháp này được sử dụng rộng rãi cho hầu hết các loại thực phẩm, mang lại kết quả chính xác bất kể loại thực phẩm hay địa lý Hiện nay, nó được coi là một trong những phương pháp xác định hàm lượng pectin hiệu quả nhất.
3.1.2 Năng lực của phương pháp đo quang phổ thông qua ion Cu 2+
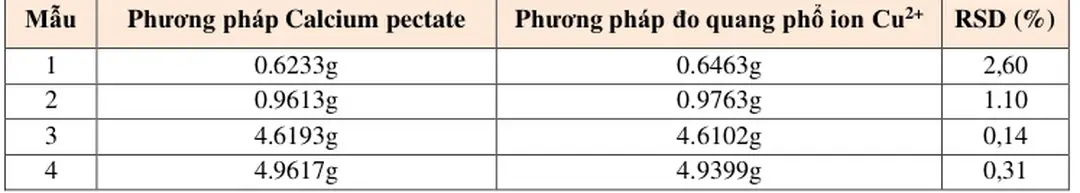
Phương pháp đo quang phổ ion Cu 2+ được phát triển bởi nhóm nghiên cứu Trung Quốc vào năm 2021 nhằm xác định hàm lượng pectin trong thực phẩm, mang lại một cách tiếp cận đơn giản hơn cho quy trình nghiên cứu Mặc dù chưa phổ biến toàn cầu, phương pháp này đã chứng minh tiềm năng vượt trội trong việc xác định hàm lượng pectin với độ chính xác cao hơn so với phương pháp Calcium pectate Để kiểm tra độ chính xác, người ta đã phân tích độ lặp lại của phương pháp qua các phép đo quang phổ ion Cu 2+, với độ lệch chuẩn tương đối (RSD) lần lượt là 2.60% và 1.10%.
0.14%; 0.31% ( 0.95) Tính chính xác và độ tin cậy của phương pháp này được chứng minh qua thí nghiệm đo quang phổ ở hai điều kiện khác nhau (100℃ trong 10 phút và 85℃ trong 5 phút), với kết quả được thể hiện qua hai đồ thị hồi quy tuyến tính.
Hình 14 Cường độ hấp thụ của D-Galacturonic acid khi thực hiện thí nghiệm ở 100℃ trong 10 phút
Hình 15 Cường độ hấp thụ của D-Galacturonic acid khi thực hiện thí nghiệm ở 85℃ trong 5 phút
Phương pháp Carbazole cho thấy độ chính xác cao với hệ số tương quan R > 0.95 trong cả hai thử nghiệm Tuy nhiên, không đạt được hệ số tương quan tối ưu R = 0.999 như phương pháp đo quang phổ ion Cu 2+ hay R = 1, do màu sắc của phương pháp Carbazole không chỉ phụ thuộc vào nồng độ D-Galacturonic acid mà còn bị ảnh hưởng bởi các phân tử khác như D-Galatose.
L-Rhamnose là 2 phân tử có độ hấp thu quang hoàn toàn khác nhau (D-Galacturonic acid chỉ chiếm tối thiểu 80% trong cấu trúc của pectin trong mẫu thực phẩm) Ngoài ra, sự hiện diện của các carbohydrate như tinh bột, cellulose và đường trung tính trong dịch chiết pectin có thể gây ra sai số trong việc phân tích
D-Galacturonic acid, vì carbazole có thể kết hợp bất kỳ phân tử đường trung tính nào có mặt để hình thành màu bổ sung, dẫn đến giá trị cường độ hấp thu xảy ra sai lệch lớn
Một trong những nhược điểm lớn của phương pháp Carbazole là không thể xác định hàm lượng pectin trong các mẫu mà hệ số thực nghiệm θ chưa được xác định Điều này có nghĩa là phương pháp này chỉ áp dụng hiệu quả đối với các loại thực phẩm đã có hệ số thực nghiệm chính xác, chẳng hạn như cam và chanh dây.
Kết luận
Phương pháp Calcium pectate hiện nay vẫn được coi là một trong những cách xác định hàm lượng pectin chính xác nhất, với nhiều ưu điểm như dễ thực hiện, thiết bị và thuốc thử sẵn có, cùng với khả năng áp dụng rộng rãi cho nhiều loại thực phẩm và các vùng miền khác nhau Tuy nhiên, nhược điểm lớn nhất của phương pháp này là thời gian thực hiện kéo dài Để khắc phục nhược điểm này, một phương pháp mới đã được phát triển song song với Calcium pectate.
Carbazole có nhược điểm lớn nhất là phạm vi áp dụng hạn chế do thiếu sót của hệ số thực nghiệm Hơn nữa, độ chính xác của phương pháp này thấp hơn so với phương pháp Calcium pectate.
Kết hợp với cả ưu, nhược điểm của cả 2 phương pháp trên, một bước tiến mới được ra đời ở Trung
Phương pháp đo quang phổ ion Cu 2+ được áp dụng vào năm 2021 nhằm xác định gián tiếp hàm lượng pectin thông qua việc đo quang phổ hấp thu của Cu 2+ Phương pháp này nổi bật với độ chính xác cao, gần như tương đương với Calcium pectate, cùng với thời gian thí nghiệm ngắn và khả năng áp dụng rộng rãi cho các mẫu trái cây khác nhau Mặc dù yêu cầu thiết bị hiện đại là nhược điểm lớn nhất, nhưng phương pháp này đã chứng minh giá trị và tiềm năng trong nghiên cứu khoa học trong tương lai.