Vật liệu và phương pháp nghiên cứu
Địa điểm nghiên cứu
Nghiên cứu thu mẫu ngoài thực địa: Vùng biển ven bờ thuộc Thành phố Đồng Hới, tỉnh Quảng Bình
Nghiên cứu trong phòng thí nghiệm:
Phòng Ký sinh trùng - Viện Sinh thái và Tài nguyên sinh vật
Phòng thí nghiệm bộ môn Công nghệ Sinh học Động vật - Học viện Nông nghiệp Việt Nam.
Thời gian nghiên cứu
Đối tượng/vật liệu nghiên cứu
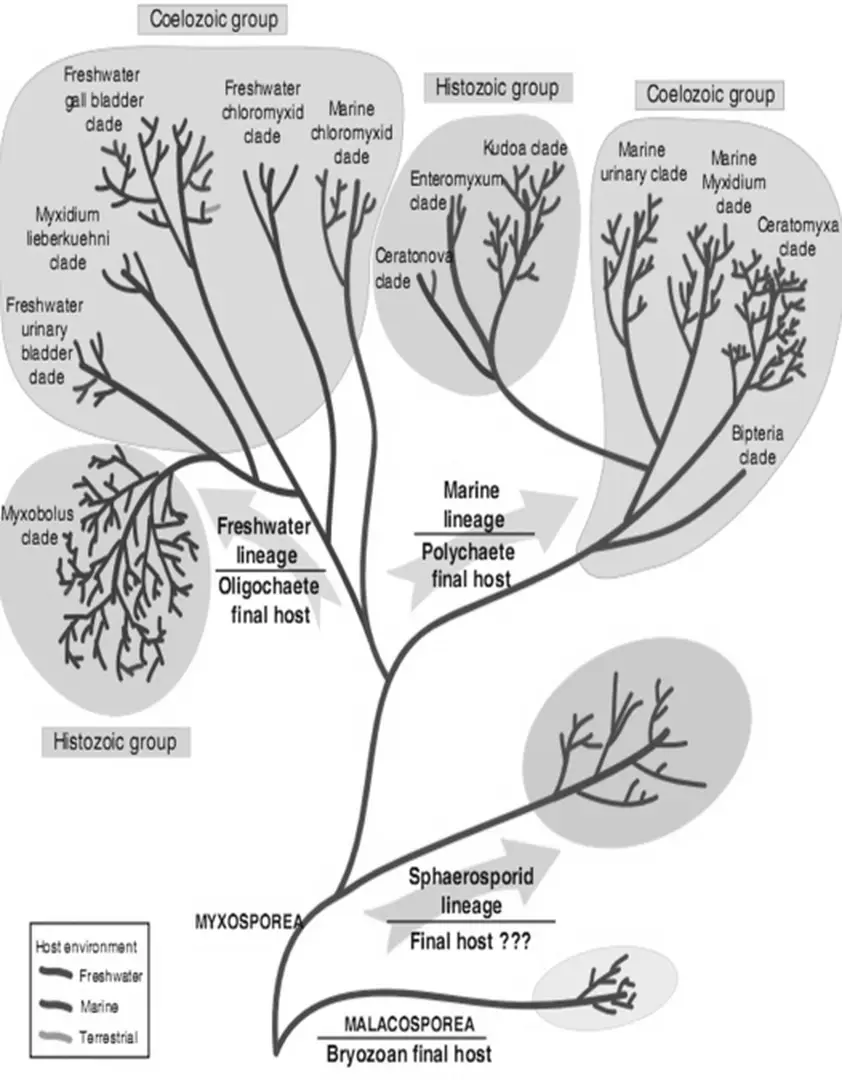
Trùng bào tử sợi thuộc lớp Myxosporea ký sinh trên cá biển
3.3.2 Các loài cá nghiên cứu
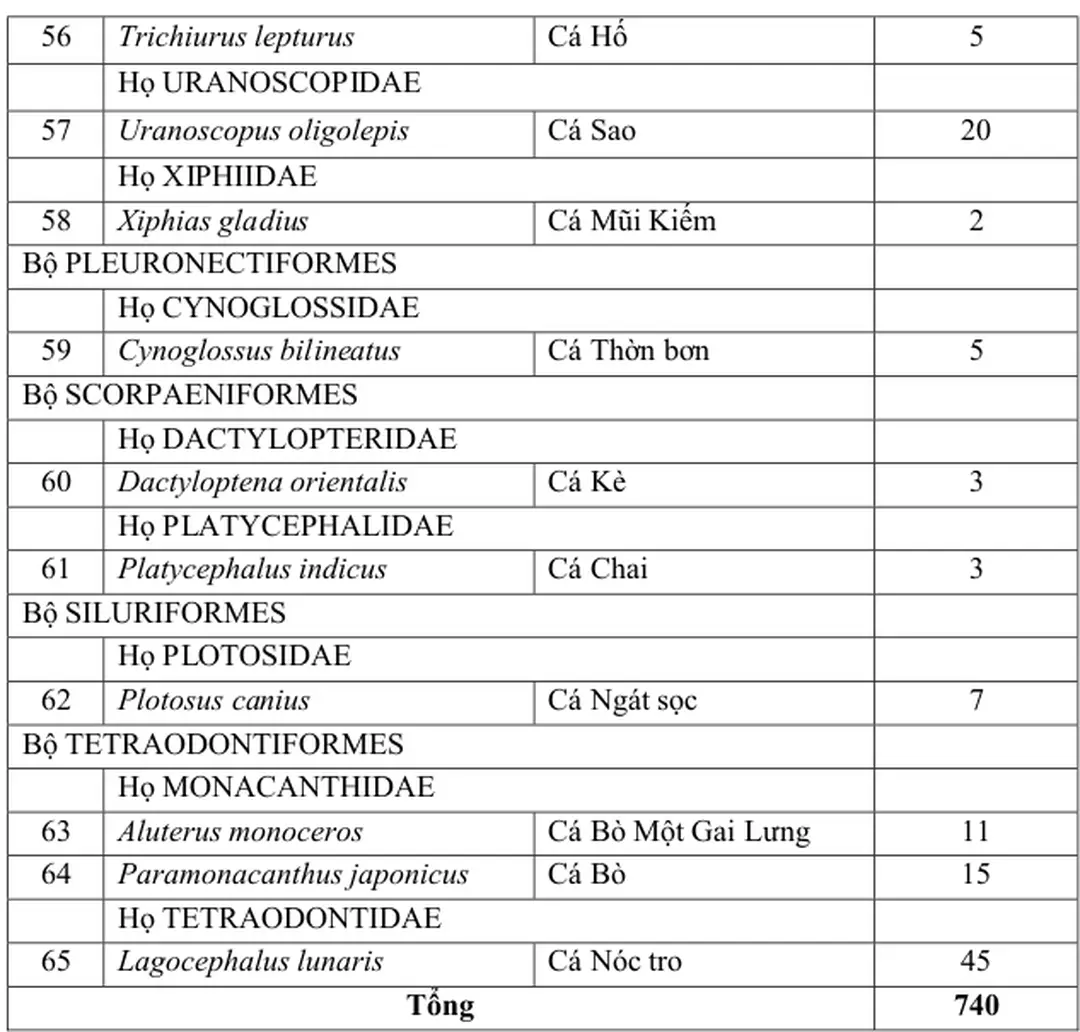
Trong nghiên cứu này, chúng tôi đã mổ khám 740 cá thể thuộc 37 họ, 8 bộ cá biển khác nhau (bảng 3.1)
Bảng 3.1 Thành phần các loài vật chủ nghiên cứu
Tên vật chủ nghiên cứu (tên khoa học, tên Việt Nam) SLMK
1 Echidna nebulosa Cá Trình Bông 9
2 Muraenesox cinereus Cá Dưa xám 15
4 Saurida elongata Cá Mối dài 3
5 Sargocentron rubrum Cá Sơn đá 5
6 Hyporhamphus quoyi Cá Kìm thân tròn 7
8 Tylosurus acus acus Cá Kìm Môi Bằng 15
10 Sardinella gibbosa Cá Trích xương 11
11 Tenualosa toli Cá Cháy bẹ 7
12 Clupanodon thrissa Cá Mòi cờ hoa 25
13 Alepes kleinii Cá Ngân, Tráo, Say 7
15 Selaroides leptolepis Cá chỉ vàng 14
16 Decapterus maruadsi Cá Nục Sồ 15
17 Carangoides malabaricus Cá Khế Mõm ngắn 15
18 Trachinotus baillonii Cá Sòng chấm 21
19 Selar crumenophthalmus Cá Bè Tráo Mắt to 16
21 Megalaspis cordyla Cá Sòng gió 20
22 Scomberoides commersonianus Cá Bè Xước 13
25 Parastromateus niger Cá Chim đen 3
26 Decapterus macarellus Cá Nục thuôn 11
27 Coryphaena hippurus Cá Nục heo cờ 5
28 Chaetodon modestus Cá Nàng Đào 3
29 Chaetodon wiebeli Cá Nàng đào vạch xiên 1
30 Gerres limbatus Cá Móm gai ngắn 22
32 Pomadasys maculatus Cá Sạo chấm 7
34 Pinjalo pinjalo Cá Hồng vây xiên 4
35 Lutjanus russelli Cá Hồng chấm đen 8
36 Branchiostegus japonicus Cá Đầu vuông Nhật bản 7
37 Monodactylus argenteus Cá Chim khoang 10
38 Upeneus sulphureus Cá Phèn hai sọc 22
40 Nemipterus hexodon Cá Lượng sáu răng 8
41 Priacanthus hamrur Cá Trác đỏ 22
43 Otolithes ruber Cá Nạng Bạc 15
44 Auxis thazard Cá Ngừ chù 15
45 Scomberomorus guttatus Cá Thu chấm 15
46 Rastrelliger brachysoma Cá Bạc má 19
47 Epinephelus melanostigma Cá mú chấm 4
48 Cephalopholis boenack Cá Mú sọc ngang 3
49 Epinephelus megachir Cá Đuối vàng 2
50 Epinephelus amblycephalus Cá Mú chấm vạch 10
52 Evynnis cardinalis Cá Bánh đường 8
53 Sphyraena obtusata Cá Nhồng đuôi vàng 3
54 Sphyraena jello Cá Nhồng vằn 13
55 Terapon jarbua Cá Ong, Căng cát 27
58 Xiphias gladius Cá Mũi Kiếm 2
59 Cynoglossus bilineatus Cá Thờn bơn 5
62 Plotosus canius Cá Ngát sọc 7
63 Aluterus monoceros Cá Bò Một Gai Lưng 11
65 Lagocephalus lunaris Cá Nóc tro 45
Nội dung nghiên cứu
- Xác định tình hình nhiễm myxosporea ở một số loài cá trong khu vực nghiên cứu
- Xác định thành phần loài myxosporea
- Mô tả các loài myxosporea.
Phương pháp nghiên cứu
3.5.1 Thu mẫu vật chủ ngoài thực địa
Vật chủ cá được thu thập sống tại các chợ cá ở khu vực nghiên cứu, sau đó được ghi tên thường gọi, phân loại theo từng loài, bảo quản lạnh trong thùng xốp và chuyển về phòng thí nghiệm Thông tin chi tiết của vật chủ được ghi lại theo phụ lục 2 Mỗi mẫu vật được chụp ảnh và đo kích thước, sau đó được định loại bằng cách tham khảo ý kiến chuyên gia từ Viện Sinh thái và Tài nguyên sinh vật hoặc so sánh trên trang web www.fishbase.org và trong sách Động vật chí phần cá biển.
3.5.2 Phương pháp thu thập mẫu ký sinh trùng
Các mẫu cơ cá được cắt mỏng và ép trên lam kính để quan sát Dưới kính hiển vi, người ta phát hiện sự hiện diện của myxosporea Những mẫu có nhiễm myxosporea được bảo quản trong dung dịch cồn 70%.
Mật được chiết xuất từ gan và sau đó được đặt lên lam kính để quan sát dưới kính hiển vi Các mẫu nhiễm myxosporea được cố định để làm tiêu bản, trong khi phần còn lại được bảo quản trong cồn 70%.
Để quan sát các mẫu dưới kính hiển vi, trước tiên cần đặt mẫu lên lam kính và phủ lamen Đối với mẫu mật, nhỏ giọt dung dịch mật lên lam kính rồi phủ lamen trước khi quan sát Còn với mẫu cơ, hãy đặt một lát cơ nhỏ lên lam kính, ép thành lớp mỏng, sau đó đậy lamen và tiến hành quan sát dưới kính hiển vi.
Dung dịch nhuộm Hematoxylin được chuẩn bị theo phương pháp của Mayer:
- Potassium aluminum sulfate (Kal(SO4)2) 100g
Để chuẩn bị dung dịch nhuộm, trước tiên, hãy đun cách thủy Hematoxylin trong nước cất ở nhiệt độ 100°C trong 5 phút để làm tan Sau đó, thêm Potassium aluminum sulfate và khuấy đều cho đến khi tan hoàn toàn Khi muối đã tan, tiếp tục thêm Sodium iodate, sau đó là Citric và Chloral hydrate.
Dung dịch nhuộm Eosin được chuẩn bị theo phương pháp của Mayer:
- Glacial acetic acid (CH3COOH) 5ml
Cách pha: Hòa tan Eosin trong nước cất có thể sử dụng máy gia nhiệt để chúng tan hoàn toàn trong nước Sau đó thêm Glacial acetic acid vào
Các bước thực hiện: phiến mô đã được sấy khô đặt vào giá thủy tinh và lần lượt nhúng vào các dung dịch theo bảng 3.2
Bảng 3.2 Quy trình nhuộn Hematoxylin - Eosin
Số thứ tự các bước Dung dịch Thời gian
7 Để dưới vòi nước chảy 2 - 3 phút
10 Để dưới vòi nước chảy 4 - 6 phút
3.5.4 Phân tích hình thái học
Quan sát tiêu bản trên kính hiển vi Olympus CH-40 ở độ phóng đại 1.000 lần Đo kích thước, chụp ảnh và vẽ myxosporea bằng phần mềm Illustrator CS2
Phương pháp định loại dựa theo khóa phân loại của Lom and Diková (1992) và theo khóa định loại của Fiala et al (2015a)
Kích thước myxosporea được đo theo phương pháp của Lom and Diková
Hình 3.1 Các số đo cần thiết để định loại ký sinh trùng myxosporea
A và B mô tả Myxobolus từ phía trước và bên; C và D là Henneguya ở hai góc nhìn khác nhau; E và F trình bày Myxidium từ hai hướng; G và H thể hiện Chloromyxum từ bên hoặc từ phía đường nối (G) và phía trước (H); I là hình ảnh Kudoa từ phía đỉnh; J cho thấy Kudoa ở một trong những điểm phụ có thể là đường chéo Các thông số quan trọng bao gồm: L là chiều dài bào tử, W là độ rộng bào tử, T là độ dày bào tử, AL là chiều dài phụ đuôi và TL là tổng chiều dài bào tử.
3.5.5 Phương pháp phân tích DNA
3.5.5.1 Phương pháp tách chiết DNA
Mẫu myxosporea được tách chiết DNA tổng số bằng DNeasy Tisue Kit (QIAgen) theo quy trình của nhà sản xuất:
1 Cho 200mg mẫu có chứa các bào tử myxosporea vào trong ống eppendorf UV-crosslinked 1.5mL
2 Cho thờm 180 àl buffer ATL, 20 àl Proteinase K vào ống cú chứa mẫu mụ tách chiết ở bước 1 và đậy nắp Trộn đều bằng Vortex trong 15 giây
3 Ủ mẫu ở 56ºC trong 3 tiếng hoặc qua đêm
4 Lấy mẫu ra khỏi mỏy ủ, vortex nhẹ; thờm 200 àl buffer Al và vortex
6 Thờm 200 àl cồn tuyệt đối và chuyển toàn bộ dung dụng này lờn cột spin
7 Ly tâm 8000 rpm trong 1 phút, loại bỏ chạy qua
8 Thờm 500 àl buffer AW1, ly tõm ở 8000 rpm trong 1 phỳt, loại bỏ dung dịch chạy qua
9 Thờm 500 àl buffer AW2, ly tõm ở 13000 rpm trong 3 phỳt, loại bỏ dung dịch chạy qua
10 Đặt cột spin lờn ống ống eppendorf UV-crosslinked 1.5mL, thờm 200 àl đệm AE Để trong 1 phút và ly tâm ở 8000 rpm trong 1 phút Dung dịch thu được có chứa DNA tổng số
The study involves the amplification of the SSU rDNA (Small subunit ribosomal DNA - 18S) sequences from myxosporea samples using PCR techniques with two primer pairs: 18e (5’-CTGGTTGATCCTGCCAGT-3’)-Kud6R (5’-TCCAGTAGCTACTCATCG-3’) and Kud6F (5’-TCACTATCGGAATGAACG-3’)-18g (5’-GGTAGTAGCGACGGGCGGCGTG-3’), following methodologies established by Hillis and Dixon (1991) and Whipps et al (2003) The PCR reaction components include 37.5 µl of H2O, 5 µl of Buffer, and dNTPs.
Quy trình nhiệt trong thí nghiệm bao gồm các giai đoạn sau: đầu tiên là giai đoạn khởi đầu ở nhiệt độ 95°C trong 5 phút để biến tính, tiếp theo là 35 chu trình nhiệt với các bước: 95°C trong 30 giây, 51°C trong 40 giây và 72°C trong 1 phút Cuối cùng, giai đoạn kết thúc kéo dài ở 72°C trong 3 phút Các thành phần được sử dụng bao gồm 2 àl primer xuụi và ngược, 1,5 àl template, cùng với 2 àl enzyme.
Để chuẩn bị gel, cân thạch agarose và hòa vào dung dịch TAE 1x, sau đó đun trong lò vi sóng cho đến khi agarose tan hoàn toàn Khi dung dịch nguội đến 60°C, đổ vào khuôn gel điện di đã lắp sẵn lược Sau 30 - 45 phút, khi gel đã đông cứng, tháo lược ra và đặt bản gel vào bể điện di chứa dung dịch TAE 1X, đảm bảo bản gel ngập trong dung dịch.
Trộn sản phẩm PCR với loading buffer 6x theo tỷ lệ 4:1 và cho vào giếng điện di Sử dụng điện thế từ 100 - 120V để thực hiện điện di, giúp DNA di chuyển từ cực âm sang cực dương Theo dõi sự di chuyển của màu loading buffer để xác định thời gian điện di hợp lý, tránh tình trạng mẫu DNA bị chạy ra ngoài.
Nhuộm gel DNA được thực hiện bằng cách ngâm bản gen trong ethidium bromide với nồng độ 0,5 µg/ml trong 15 phút, kết hợp với lắc nhẹ Sau đó, gel sẽ được rửa dưới dòng nước chảy Cuối cùng, sản phẩm PCR được đánh giá bằng cách soi gel dưới đèn UV và chụp ảnh bằng máy ảnh Canon 750D.
3.5.5.3 Phương pháp phân tích số liệu
Sản phẩm PCR được gửi đi tinh sạch và giải trình tự tại Macrogen (Hàn Quốc) Chúng tôi sử dụng chương trình BLAST để so sánh mức độ tương đồng của trình tự thu được với các trình tự trên Genbank Để phân tích mối quan hệ tiến hóa phân tử, các trình tự thu được được so sánh với các trình tự tương đồng trên Genbank bằng phần mềm MEGA 6 theo phương pháp Neighbor Joining (Tamura et al., 2013).